Giải đề thi hết học kì II (2018 - 2019) trường THPT Lý Tự Trọng Nam Định
Đề bài
I. TRẮC NGHIỆM (5,0 điểm)
Câu 1 : Hiđrocacbon thơm A có %C (theo khối lượng) là 92,3%. A tác dụng với dung dịch brom dư cho sản phẩm có %C (theo khối lượng) là 36,36%. Biết MA < 120. Tên gọi của A là
A. toluen.
B. benzen.
C. stiren.
D. cumen.
Câu 2 : Cho phản ứng
CH3CHO + 2AgNO3 + 3NH3 + H2O \(\xrightarrow{{{t}^{o}}}\) CH3COONH4 + NH4NO3 + 2Ag.
Vai trò của CH3CHO trong phản ứng trên là:
A. chất oxi hóa.
B. axit.
C. bazơ.
D. chất khử.
Câu 3 : Cho sơ đồ phản ứng sau:
\({{C}_{2}}{{H}_{4}}\xrightarrow{+A}{{C}_{2}}{{H}_{5}}Br\xrightarrow{+B({{t}^{o}})}{{C}_{2}}{{H}_{5}}OH\xrightarrow{+D(xt)}C{{H}_{3}}\text{COOH}\)
Công thức của A, B, D trong sơ đồ trên lần lượt là:
A. HBr, NaOH, O2.
B. Br2, KOH, CuO.
C. HBr, NaOH, CuO.
D. Br2, KOH, O2.
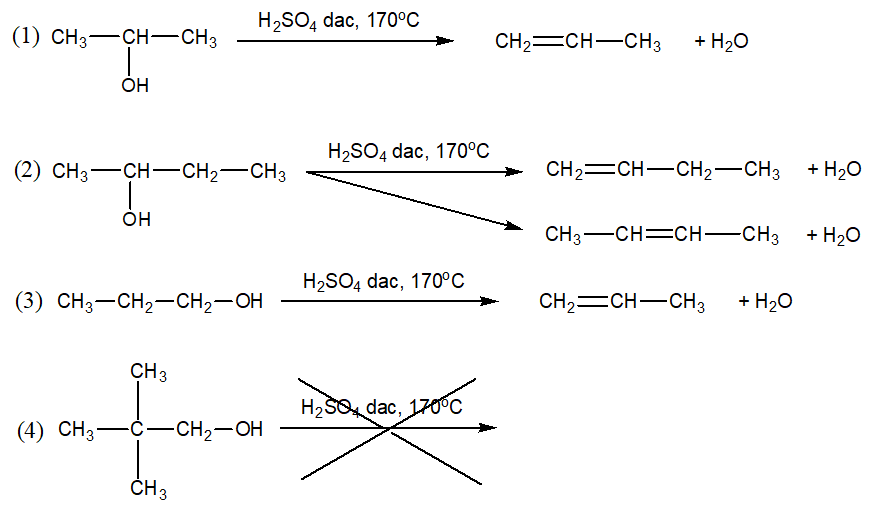
Câu 4 : Đun nóng một ancol X với H2SO4 đậm đặc ở nhiệt độ thích hợp thu được một anken duy nhất. Trong các công thức sau:
Công thức nào phù hợp với X?
A. (1), (2), (3).
B. (1), (3), (4).
C. (1), (2), (4).
D. (1), (3).
Câu 5 : Cho 46 gam dung dịch glixerol 80% với một lượng dư Na, thu được V lít khí (đktc). Giá trị của V là
A. 16,8 lít.
B. 13,44 lít.
C. 19,16 lít.
D. 15,68 lít.
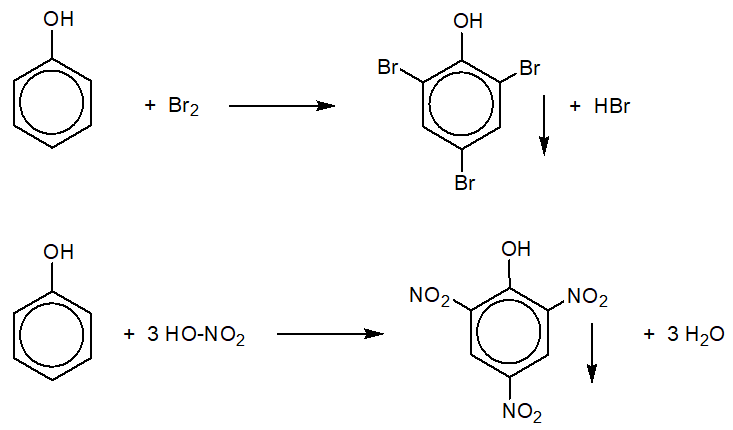
Câu 6 : Phenol không tác dụng với
A. dung dịch HCl.
B. dung dịch Br2.
C. kim loại Na.
D. dung dịch NaOH.
Câu 7 : Cho a mol một ancol X tác dụng với Na thu được \(\frac{a}{2}\) mol H2. Đốt cháy hoàn toàn X thu được 13,2 gam CO2 và 8,1 gam H2O. Vậy X là
A. C3H7OH.
B. C2H5OH.
C. C4H9OH.
D. C2H4(OH)2.
Câu 8 : Etanol và phenol đồng thời phản ứng được với
A. Na, dung dịch Br2.
B. Na, CH3COOH.
C. Na.
D. Na, NaOH.
Câu 9 : Hiđrocacbon thơm có công thức phân tử C8H10. Số đồng phân là:
A. 1.
B. 4.
C. 2.
D. 3.
Câu 10 : Số đồng phân ancol bậc I ứng với công thức phân tử C4H10O là
A. 4.
B. 5.
C. 3.
D. 2.
Câu 11 : Anđehit no, đơn chức, mạch hở có công thức chung là
A. CnH2nO2 (n ≥ 1).
B. CnH2nO (n ≥ 1).
C. CnH2n-2O (n ≥ 3).
D. CnH2n+2O (n ≥ 1).
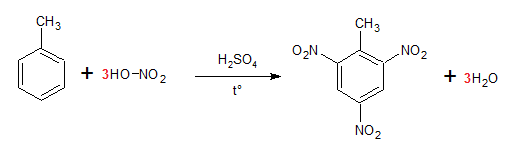
Câu 12 : Chất nào sau đây được dùng để sản xuất thuốc nổ TNT?
A. Benzen.
B. Toluen.
C. Stiren.
D. Xilen.
Câu 13 : Stiren không có khả năng phản ứng với
A. dung dịch brom.
B. brom khan có xúc tác bột Fe.
C. dung dịch KMnO4.
D. dung dịch AgNO3/NH3.
Câu 14 : Đun nóng etanol với H2SO4 đặc ở 140oC thu được sản phẩm chính là
A. C2H4.
B. C2H5OSO3H.
C. CH3OCH3.
D. C2H5OC2H5.
Câu 15 : Cho 0,87 gam một anđehit no, đơn chức X phản ứng hoàn toàn với AgNO3 trong amoniac sinh ra 3,24 gam Ag. Công thức cấu tạo của X là (Ag=108, C=12, H=1, O=16)
A. CH3CH2CHO.
B. CH3CHO.
C. HCHO.
D. CH3CH2CH2CHO.
Câu 16 : Tính chất nào không phải của benzen?
A. Tác dụng với Br2 (Fe, to).
B. Tác dụng với Cl2 (a/s).
C. Tác dụng với dung dịch HNO3(đ)/H2SO4 (to).
D. Tác dụng với dung dịch AgNO3/NH3.
Câu 17 : Chọn cụm từ đúng nhất để điền vào chỗ trống sau:
"Nhiệt độ sôi của ancol cao hơn hẳn nhiệt độ sôi của ankan tương ứng là vì giữa các phân tử ancol tồn tại …"
A. liên kết cộng hoá trị.
B. liên kết phối trí.
C. liên kết hiđro.
D. liên kết ion.
Câu 18 : Khi đun nóng propan-2-ol với H2SO4 đặc ở 170oC thu được sản phẩm chính là
A. propan.
B. đipropyl ete.
C. propen.
D. etylmetyl ete.
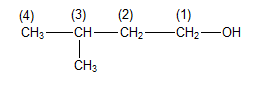
Câu 19 : Hợp chất có công thức cấu tạo sau: CH3-CH(CH3)-CH2-CH2-OH, có tên gọi là
A. 2-metylbutan-4-ol.
B. 4-metylbutan-1-ol.
C. pentan-1-ol.
D. 3-metylbutan-1-ol.
Câu 20 : Số đồng phân anđehit có cùng công thức C4H8O là
A. 2.
B. 3.
C. 4.
D. 1.
II. TỰ LUẬN (5,0 điểm)
Câu 21 : Viết các phương trình phản ứng (nếu xảy ra) khi cho:
a) Etanol tác dụng lần lượt với các chất sau: Na, CuO đun nóng, HBr có xúc tác NaOH.
b) Phenol tác dụng với lần lượt các chất sau: dd NaOH, dd Br2, dd HNO3, dd NaCl.
Câu 22 : Nhận biết các chất lỏng không màu sau đựng riêng trong các lọ mất nhãn:
Etanol, glixerol, stiren, benzen.
Câu 23 : Lấy 4,04 gam hỗn hợp A gồm 2 ancol no, đơn chức, mạch hở, kế tiếp nhau trong cùng dãy đồng đẳng tác dụng với Na kim loại dư thu được 1,12 lít khí H2 (đktc).
a) Tìm công thức phân tử của 2 ancol.
b) Tính thành phần phần trăm về khối lượng của từng ancol trong A.
c) Oxi hóa hoàn toàn 4,04 gam hỗn hợp ancol nói trên bằng CuO nung nóng, đem toàn bộ sản phẩm hữu cơ cho tác dụng với lượng dư dung dịch AgNO3/NH3 thì thu được a gam kết tủa Ag. Tính a.
Câu 24 : Đun nóng 0,03 mol hỗn hợp X gồm 2 ancol A và B (MA < MB) với H2SO4 đậm đặc ở 140oC thì thu được 0,742 gam hỗn hợp ba ete. Tách lấy phần ancol chưa tham gia phản ứng (ancol A còn lại 40% và ancol B còn lại 60% so với lượng mỗi ancol ban đầu) và đun nóng với H2SO4 đặc ở 170oC thì thu được V lít (đktc) hỗn hợp 2 anken không phải là đồng phân của nhau. Giả sử phản ứng tạo anken là xảy ra hoàn toàn.
a) Xác định công thức phân tử của A và B biết khối lượng phân tử của chúng khác nhau 28 đvC.
b) Tính giá trị của V.
----- HẾT -----
Lời giải chi tiết
ĐÁP ÁN VÀ LỜI GIẢI CHI TIẾT
1.C | 2.D | 3.C | 4.D | 5.C | 6.A | 7.B | 8.C | 9.B | 10.D |
11.B | 12.B | 13.D | 14.D | 15.A | 16.D | 17.C | 18.C | 19.D | 20.A |
Câu 1
Phương pháp:
- A có CTPT là CxHy thì ta có x : y = \(\frac{{\% {m_C}}}{{{M_C}}}:\frac{{\% {m_H}}}{{{M_H}}}\) ⟹ CTĐGN của A.
- Dựa vào dữ kiện MA < 120 để lập luận suy ra các CTPT có thể có của A.
- Dựa vào dữ kiện "A tác dụng với dung dịch brom dư cho sản phẩm có %C (theo khối lượng) là 36,36%" tìm ra CTCT thỏa mãn.
Cách giải:
A có CTPT là CxHy thì ta có
\(x:y = \frac{{\% {m_C}}}{{{M_C}}}:\frac{{\% {m_H}}}{{{M_H}}} = \frac{{92,3\% }}{{12}}:\frac{{100\% {\rm{\;}} - 92,3\% }}{1} = 1:1\)
⟹ CTĐGN là CH ⟹ CTPT có dạng CnHn
Theo đề bài, MA < 120 ⟹ 13n < 120 ⟹ n < 9,23
Mặt khác A là hiđrocacbon thơm nên có tối thiểu 6C ⟹ 6 ≤ n < 9,23
Trong phân tử hiđrocacbon, số nguyên tử H là số chẵn nên n = 6 hoặc n = 8
+ Nếu n = 6 ⟹ A là C6H6
C6H6 + nBr2 → C6H6-nBrn + nHBr
Ta có phương trình:
\(\% {m_C} = \frac{{72}}{{78 + 79n}}.100\% {\rm{\;}} = 36,36\% {\rm{\;}} \to n = 1,56\) (loại)
+ Nếu n = 8 ⟹ A là C8H8
C6H5CH=CH2 + Br2 → C6H5CHBr-CH2Br
\( \to \% {m_C} = \frac{{12.8}}{{12.8 + 8 + 80.2}}.100\% {\rm{\;}} = 36,36\% \) (thỏa mãn)
Vậy A là C8H8.
Chọn C.
Câu 2
Phương pháp:
- Xác định số oxi hóa của các nguyên tố trong CH3CHO và CH3COONH4
Cách xác định số oxi hóa trong hợp chất hữu cơ:
1. H có số oxi hóa +1; O có số oxi hóa -2
2. Số oxi hóa của 1 cụm nguyên tử C bằng 0
VD1: CH3-COOH có 2 cụm C
+ Cụm 1: CH3 thì H là +1 và C là -3
+ Cụm 2: COOH thì H là +1; O là -2 suy ra C là +3
VD2: CH3-CH2OH có 2 cụm C
+ Cụm 1: CH3 thì H là +1 và C là -3
+ Cụm 2: CH2OH thì H là +1; O là -2 suy ra C là -1
- Từ đó xác định vai trò của CH3CHO trong phản ứng
Cách giải:
- Xác định số oxi hóa: \(\mathop {{\rm{ }}C}\limits^{ - 3} {\mathop {{\rm{ }}H}\limits^{ + 1} _3} - \mathop {{\rm{ }}C}\limits^{ + 1} \mathop {{\rm{ }}H}\limits^{ + 1} \mathop {{\rm{ }}O}\limits^{ - 2} \); \(\mathop {{\rm{ }}C}\limits^{ - 3} {\mathop {{\rm{ }}H}\limits^{ + 1} _3} - \mathop {{\rm{ }}C}\limits^{ + 3} \mathop {{\rm{ }}O}\limits^{ - 2} \mathop {{\rm{ }}O}\limits^{ - 2} \mathop {{\rm{ }}N}\limits^{ - 3} {\mathop {{\rm{ }}H}\limits^{ + 1} _4}\)
- Ta thấy: \(\mathop {{\rm{ }}C}\limits^{ + 1} {\rm{\;}} \to \mathop {{\rm{ }}C}\limits^{ + 3} {\rm{\;}} + 2{\rm{e}}\) ⟹ CH3CHO nhường e nên là chất khử
Chọn D.
Câu 3
Phương pháp:
Dựa vào các chất đã biết để xác định những chất A, B, D.
Cách giải:
A + C2H4 → C2H5Br nên A là HBr ⟹ loại B và D.
C2H5Br + B → C2H5OH nên B có thể là NaOH hoặc KOH.
C2H5OH + D \(\xrightarrow{xt}\) CH3COOH nên D là O2 ⟹ loại A.
Chọn C.
Câu 4
Phương pháp:
Viết PTHH xác định sản phẩm khi tách nước X với xt H2SO4 đậm đặc.
Cách giải:
Công thức phù hợp với X là (1), (3).
Chọn D.
Câu 5
Phương pháp:
Từ khối lượng dung dịch glixerol và C% tính số mol H2O và C3H5(OH)3.
Cách giải:
Ta có: mC3H5(OH)3 = \(46.\frac{{80}}{{100}}\) = 36,8 gam
⟹ nC3H5(OH)3 = \(\frac{{36,8}}{{92}}\) = 0,4 mol
⟹ mH2O = 46 – 36,8 = 9,2 gam
⟹ nH2O = \(\frac{{9,2}}{{18}}\) = 23/45 mol
Khi cho dung dịch glixerol phản ứng với Na thì cả H2O và C3H5(OH)3 đều phản ứng:
2H2O + 2Na → 2NaOH + H2
23/45 → 23/90 (mol)
2C3H5(OH)3 + 6Na → 2C3H5(ONa)3 + 3H2
0,4 → 0,6 (mol)
\( \to {V_{{H_2}}} = 22,4.\left( {\frac{{23}}{{90}} + 0,6} \right) \approx 19,16\left( l \right)\)
Chọn C.
Chú ý khi giải:
Lưu ý: Cả glixerol và nước đều phản ứng với Na:
2C3H5(OH)3 → 3H2
2H2O → H2
Chọn C.
Câu 6 (NB):
Phương pháp:
Xem lại TCHH của phenol.
Cách giải:
- Phenol không phản ứng với dung dịch HCl.
- Phenol tác dụng với Br2, Na, NaOH theo các PTHH:
C6H5OH + 3Br2 → C6H2Br3OH ↓ + 3HBr
2C6H5OH + 2Na → 2C6H5ONa + H2
C6H5OH + NaOH → C6H5ONa + H2O
Chọn A.
Câu 7 (VD):
Phương pháp:
Vì nH2 = nX nên X có 1 nhóm OH (*)
Đốt cháy X có nCO2 < nH2O ⟹ X là ancol no (**)
Từ (*) và (**) ⟹ Z là ancol no, đơn chức
- Tính số mol của X theo công thức tính nhanh khi đốt ancol no, mạch hở:
nX = nH2O – nCO2
- Tính số nguyên tử C của X:
Số nguyên tử C = nC : nX = nCO2 : nX
Cách giải:
Vì nH2 = nX nên X có 1 nhóm OH (*)
Đốt cháy X có nCO2 (= 0,3 mol) < nH2O (= 0,45 mol) ⟹ X là ancol no (**)
Từ (*) và (**) ⟹ Z là ancol no, đơn chức, mạch hở
Khi đốt ancol no, mạch hở ta có: nX = nH2O – nCO2 = 0,45 – 0,3 = 0,15 mol
Số nguyên tử C = nC : nX = nCO2 : nX = 0,3 : 0,15 = 2
⟹ X là C2H5OH.
Chọn B.
Câu 8
Phương pháp:
Tính chất hóa học của ancol, phenol.
Cách giải:
A sai, vì etanol không tác dụng với Br2.
B sai, vì phenol không tác dụng với CH3COOH.
C đúng.
D sai, vì etanol không tác dụng với NaOH.
Chọn C.
Câu 9
Phương pháp:
Hiđrocacbon thơm là hiđrocacbon có chứa vòng benzen ⟹ các CTCT thỏa mãn.
Cách giải:
Các CTCT phù hợp là:
C6H5CH2CH3
CH3-C6H4-CH3 (3 đồng phân o, m, p)
⟹ có 4 CTCT thỏa mãn.
Chọn B.
Câu 10
Phương pháp:
Ancol bậc I là ancol có nhóm OH đính với C bậc 1 (là C chỉ liên kết với 1 nguyên tử C khác).
Cách giải:
Các đồng phân ancol bậc 1 có CTPT C4H10O là:
CH3-CH2-CH2-CH2-OH
CH3-CH(CH3)-CH2-OH
⟹ 2 đồng phân
Chọn D.
Câu 11
Phương pháp:
Xem lại lý thuyết anđehit.
Cách giải:
Anđehit no, đơn chức, mạch hở có công thức chung là CnH2nO (n ≥ 1).
Chọn B.
Câu 12
Phương pháp:
Xem lại bài hiđrocacbon thơm.
Cách giải:
TNT là tên viết tắt của trinitro toluen, được điều chế bằng phản ứng HNO3 với toluen:
Chọn B.
Câu 13
Phương pháp:
Dựa vào tính chất hóa học của stiren.
Cách giải:
Cấu tạo của stiren là C6H5CH=CH2.
+ Stiren có liên kết đôi -CH=CH2 nên có khả năng phản ứng với dung dịch Br2 và KMnO4 tương tự như anken.
+ Stiren có vòng thơm nên có khả năng như benzen nên có phản ứng với brom khan có xúc tác Fe.
⟹ Stiren không phản ứng với AgNO3/NH3.
Chọn D.
Câu 14
Phương pháp:
Dựa vào tính chất hóa học của ancol.
Cách giải:
Đun nóng ancol với H2SO4 đặc ở 140oC ưu tiên phản ứng tạo ete:
PTHH: 2C2H5OH \(\overset{{{H}_{2}}S{{O}_{4}}dac,{{t}^{o}}}{→}\) C2H5OC2H5 (đietyl ete) + H2O
Chọn D.
Câu 15
Phương pháp:
Xét 2 trường hợp:
- Nếu X là HCHO: HCHO → 4Ag
+ Từ mol Ag tính được mol HCHO
+ Tính khối lượng của HCHO và so sánh với khối lượng HCHO đề cho
- Nếu X không phải HCHO: RCHO → 2Ag
+ Từ mol Ag tính được mol anđehit
+ Tính được khối lượng mol anđehit
+ Kết luận CTCT
Cách giải:
Ta có: \({n_{Ag}} = \frac{{3,24}}{{108}} = 0,03\left( {mol} \right)\)
- Nếu X là HCHO: HCHO → 4Ag
\( \to {n_{HCHO}} = \frac{1}{4}{n_{Ag}} = \frac{1}{4}.0,03 = 0,0075\left( {mol} \right)\)
⟹ mHCHO = 0,0075.30 = 0,225 gam ≠ 0,87 gam
Vậy loại trường hợp này.
- Nếu X không phải HCHO: RCHO → 2Ag
\( \to {n_X} = \frac{1}{2}{n_{Ag}} = \frac{1}{2}.0,03 = 0,015\left( {mol} \right)\)
\( \to {M_X} = \frac{{{m_X}}}{{{n_X}}} = \frac{{0,87}}{{0,015}} = 58\)
→ R + 29 = 58 → R = 29 (C2H5-)
Vậy X là CH3CH2CHO.
Chọn A.
Câu 16
Phương pháp:
Dựa vào tính chất hóa học của benzen.
Cách giải:
- Benzen có khả năng phản ứng với Br2 (Fe, to), Cl2 (a/s), dung dịch HNO3(đ)/H2SO4 (to):
C6H6 + Br2 \(\xrightarrow[1:1]{xtF\text{e}}\) C6H5Br + HBr
C6H6 + 3Cl2 \(\xrightarrow{a/s}\) C6H6Cl6
C6H6 + HNO3 \(\xrightarrow{{{H}_{2}}S{{O}_{4}}dac,{{t}^{o}}}\) C6H5NO2 + H2O
- Benzen không phản ứng với AgNO3/NH3.
Chọn D.
Câu 17
Phương pháp:
Dựa vào cấu tạo và tính chất vật lí của ancol.
Cách giải:
"Nhiệt độ sôi của ancol cao hơn hẳn nhiệt độ sôi của ankan tương ứng là vì giữa các phân tử ancol tồn tại liên kết hiđro."
Chọn C.
Câu 18
Phương pháp:
Đun nóng ancol với H2SO4 đặc ở 170oC ưu tiên phản ứng tạo anken.
Cách giải:
Đun nóng ancol với H2SO4 đặc ở 170oC ưu tiên phản ứng tạo anken.
PTHH: CH3-CHOH-CH3 \(\xrightarrow{{{H}_{2}}S{{O}_{4}}d,{{170}^{o}}C}\) CH3-CH=CH2 + H2O.
Vậy sản phẩm chính thu được là CH3-CH=CH2 (propen).
Chọn C.
Câu 19
Phương pháp:
*Tên thông thường: Ancol + tên gốc hiđrocacbon + ic
*Tên thay thế: Tên hiđrocacbon tương ứng theo mạch chính + số chỉ vị trí nhóm OH + ol
+ Mạch chính được quy định là mạch C dài nhất có chứa nhóm OH
+ Số chỉ vị trí được bắt đầu từ phía gần nhóm OH hơn
Cách giải:
⟹ Tên của hợp chất là 3-metylbutan-1-ol.
Chọn D.
Câu 20
Phương pháp:
Viết các công thức đồng phân anđehit (chứa nhóm -CHO) của C4H8O.
Cách giải:
Các đồng phân anđehit ứng với CTPT C4H8O là:
CH3CH2CH2CHO
CH3-CH(CH3)-CHO
⟹ 2 CTCT thỏa mãn
Chọn A.
Câu 21 (NB):
a)
Phương pháp:
Xem lại TCHH của ancol.
Cách giải:
2C2H5OH + 2Na → 2C2H5ONa + H2
C2H5OH + CuO \(\xrightarrow{{{t}^{o}}}\) CH3CHO + Cu + H2O
b)
Phương pháp:
Xem lại TCHH của phenol.
Cách giải:
NaOH + C6H5OH → C6H5ONa + H2O
Câu 22
Phương pháp:
Xem lại TCHH của các chất đã cho ⟹ chọn ra TCHH khác biệt của 3 chất để chọn thuốc thử phù hợp có thể phân biệt các chất.
Cách giải:
- Trích mẫu thử của từng chất vào ống nghiệm riêng biệt, đánh số thứ tự tương ứng:
- Nhỏ vài giọt dung dịch brom vào từng mẫu thử:
+ Nếu dung dịch Br2 nhạt màu hoặc mất màu ⟹ stiren
+ Nếu dung dịch Br2 không nhạt màu ⟹ etanol, glixerol, benzen
- Cho Cu(OH)2 vào ống nghiệm chứa dd etanol, glixerol, benzen:
+ Nếu dung dịch thu được có màu xanh lam đặc trưng ⟹ C3H5(OH)3
+ Không hiện tượng ⟹ etanol, benzen
- Cho Na vào ống nghiệm chứa etanol và benzen:
+ Xuất hiện khí không màu ⟹ etanol
+ Không hiện tượng ⟹ benzen
PTHH:
Br2 (màu vàng) + C6H5CH=CH2 → C6H5CHBr-CH2Br (không màu)
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu (màu xanh lam) + 2H2O
2C2H5OH + 2Na → 2C2H5ONa + H2 ↑ không màu
Câu 23 (VD):
a)
Phương pháp:
Gọi công thức chung của 2 ancol là CnH2n+1OH
2CnH2n+1OH + 2Na → 2CnH2n+1ONa + H2
Từ số mol H2 tính được số mol hỗn hợp ancol
Suy ra khối lượng mol trung bình của hỗn hợp ⟹ giá trị của n
Kết luận CTPT của 2 ancol
Cách giải:
Ta có: nH2 = 0,05 mol
Gọi công thức chung của 2 ancol là CnH2n+1OH
2CnH2n+1OH + 2Na → 2CnH2n+1ONa + H2
0,1 ← 0,05 mol
\( \to {M_A} = \frac{{{m_A}}}{{{n_A}}} = \frac{{4,04}}{{0,1}} = 40,4\)
⟹ 14n + 18 = 40,4 ⟹ n = 1,6
Vì 2 ancol trong A kế tiếp nhau trong dãy đồng đẳng ancol no, đơn chức, mạch hở
⟹ 2 ancol là CH3OH và C2H5OH
b)
Phương pháp:
- Đặt ẩn là số mol mỗi ancol
- Lập hệ phương trình về khối lượng và số mol của hỗn hợp A
- Giải hệ tìm được số mol mỗi ancol
- Tính thành phần phần trăm khối lượng mỗi ancol
Cách giải:
Đặt nCH3OH = x mol và nC2H5OH = y mol thì ta có hệ phương trình sau
\(\left\{ {\begin{array}{*{20}{l}}{{m_A} = 32{\rm{x}} + 46y = 4,04}\\{{n_A} = x + y = 0,1}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{x = 0,04}\\{y = 0,06}\end{array}} \right.\)
Thành phần % về khối lượng từng ancol trong A là:
%mCH3OH = \(\frac{{0,04.32}}{{4,04}}.100\% \) = 31,68%
%mC2H5OH = 100% - 31,68% = 68,32%
c)
Phương pháp:
Tính toán theo các PTHH.
Cách giải:
Tóm tắt sơ đồ:
CH3OH → HCHO → 4Ag
0,04 → 0,04 → 0,16 (mol)
C2H5OH → CH3CHO → 2Ag
0,06 → 0,06 → 0,12 (mol)
⟹ nAg = 0,16 + 0,12 = 0,28 mol
⟹ a = 108.0,28 = 30,24 gam
Câu 24
a)
Phương pháp:
- Tách nước 2 ancol thu được 2 anken không phải là đồng phân nên mỗi ancol tạo anken tương ứng ⟹ 2 ancol no, đơn chức, mạch hở (1)
- Vì 2 ancol tách nước thu được anken ở thể khí ⟹ số C của mỗi anken thuộc [2; 4] ⟹ Số C của mỗi ancol thuộc [2; 4] (2)
- Mà phân tử khối của A và B hơn kém nhau 28 đvC tức là hơn kém nhau 2 nhóm CH2 ⟹ A hơn B 2 nguyên tử C (3)
Kết hợp (1) (2) (3) suy ra CTPT của 2 ancol trong hỗn hợp ban đầu
Cách giải:
- Tách nước 2 ancol thu được 2 anken không phải là đồng phân nên mỗi ancol tạo anken tương ứng
⟹ 2 ancol no, đơn chức, mạch hở (1)
- Vì 2 ancol tách nước thu được anken ở thể khí ⟹ số C của mỗi anken thuộc [2; 4]
⟹ Số C của mỗi ancol thuộc [2; 4] (2)
- Mà phân tử khối của A và B hơn kém nhau 28 đvC tức là hơn kém nhau 2 nhóm CH2
⟹ A hơn B 2 nguyên tử C (3)
Kết hợp (1) (2) (3) suy ra CTPT của 2 ancol trong hỗn hợp ban đầu:
A: C2H6O
B: C4H10O
b)
Phương pháp:
Đặt mol của mỗi ancol trong hỗn hợp đầu là x, y (mol)
+ Từ số mol hỗn hợp → pt (*)
+ Tính được nancol pư → số mol H2O sinh ra Áp dụng định luật bảo toàn khối lượng → pt (**)
Giải hệ tìm được x, y.
Tách nước lượng ancol còn dư để tạo anken thì toàn bộ lượng ancol dư sẽ chuyển thành anken Khi đó tính được giá trị V.
Cách giải:
Đặt mol C2H6O và C4H10O trong hỗn hợp đầu là x, y (mol)
+ nhỗn hợp = x + y = 0,03 (*)
+ nancol pư = 0,6x + 0,4y (mol) → nH2O = 0,5.nancol pư = 0,3x + 0,2y (mol)
BTKL: m ancol pư = m ete + mH2O → 46.0,6x + 74.0,4y = 0,742 + 18(0,3x + 0,2y) (**)
Giải hệ (*) và (**) ta được x = 0,01 và y = 0,02
Khi tách nước ancol tạo anken thì toàn bộ lượng ancol dư sẽ chuyển thành anken:
n anken = n ancol dư = 0,01.40% + 0,02.60% = 0,016 mol
→ V = 0,3584 lít
Xemloigiai.com
- Giải đề thi kì 2 môn hoá lớp 11 năm 2019 - 2020 trường THPT Phú Lương
- Giải đề thi học kì II Hóa 11 sở giáo dục tỉnh Bình Thuận
- Giải đề thi học kì II hóa học lớp 11 trường THPT Nguyễn Khuyến sở GD tp Hồ Chí Minh
- Giải đề thi học kì II hóa 11 trường THPT Việt Đức - Hà Nội
- Giải đề thi kì 2 môn hoá lớp 11 năm 2019 - 2020 trường THPT Lê Qúy Đôn
- Giải đề thi học kì II Hóa lớp 11 trường THPT Kim Bảng - Hà Nam
- Giải đề thi hết học kì II Hóa 11 Trường THPT Hồng Đức - TPHCM
- Giải đề thi hết học kì II năm học 2019 - 2020 trường THPT Nguyễn Viết Xuân
- Giải đề thi hết học kì II năm học 2019 - 2020 trường THPT Nghĩa Hưng - Nam Định
- Giải đề thi hết học kì II năm học 2019 - 2020 trường THPT Kim Bảng Hà Nam
- Giải đề thi học kì II (2018 - 2019) trường THPT Nguyễn Chí Thanh Quảng Bình
- Đề số 1 - Đề kiểm tra học kì 2 - Hóa học 11
- Đề số 2 - Đề kiểm tra học kì 2 - Hóa học 11
- Đề số 3 - Đề kiểm tra học kì 2 - Hóa học 11
- Đề số 4 - Đề kiểm tra học kì 2 - Hóa học 11
- Đề số 5 - Đề kiểm tra học kì 2 - Hóa học 11
SGK Hóa lớp 11
Giải bài tập hóa học lớp 11 đầy đủ công thức, lý thuyết, phương trình hóa học, chuyên đề hóa học SGK 11 giúp để học tốt hóa học 11, luyện thi THPT Quốc gia
CHƯƠNG 1: SỰ ĐIỆN LI
- Bài 1. Sự điện li
- Bài 2. Axit, bazơ và muối
- Bài 3. Sự điện li của nước. pH. Chất chỉ thị Axit - bazơ
- Bài 4. Phản ứng trao đổi ion trong dung dịch các chất điện li
- Bài 5. Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
- Bài 6. Bài thực hành 1: Tính axit-bazơ. Phản ứng trao đổi ion trong dung dịch các chất điện li
- Đề kiểm tra 15 phút - Chương I - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương I - Hóa học 11
Đề kiểm tra giữa kì - Hóa học 11
CHƯƠNG 2: NITƠ - PHOTPHO
- Bài 7. Nitơ
- Bài 8. Amoniac và muối amoni
- Bài 9. Axit nitric và muối nitrat
- Bài 10. Photpho
- Bài 11. Axit photphoric và muối photphat
- Bài 12. Phân bón hóa học
- Bài 13. Luyện tập: Tính chất của Nitơ, photpho và các hợp chất của chúng
- Bài 14. Bài thực hành 2: Tính chất của một số hợp chất nitơ, photpho
- Đề kiểm tra 15 phút - Chương II - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương II - Hóa học 11
CHƯƠNG 3: CACBON - SILIC
- Bài 15. Cacbon
- Bài 16. Hợp chất của cacbon
- Bài 17. Silic và hợp chất của silic
- Bài 18. Công nghiệp silicat
- Bài 19. Luyện tập: Tính chất của cacbon, silic và các hợp chất của chúng
- Đề kiểm tra 15 phút - Chương III - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương III - Hóa học 11
CHƯƠNG 4: ĐẠI CƯƠNG VỀ HÓA HỌC HỮU CƠ
- Bài 20. Mở đầu về hoá học hữu cơ
- Bài 21. Công thức phân tử hợp chất hữu cơ
- Bài 22. Cấu trúc phân tử hợp chất hữu cơ
- Bài 23. Phản ứng hữu cơ
- Bài 24. Luyện tập: Hợp chất hữu cơ, công thức phân tử và công thức cấu tạo
- Đề kiểm tra 15 phút - Chương IV - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương IV - Hóa học 11
ĐỀ THI HỌC KÌ 1 MỚI NHẤT CÓ LỜI GIẢI
CHƯƠNG 5: HIDROCACBON NO
- Bài 25. Ankan
- Bài 26. Xicloankan
- Bài 27. Luyện tập ankan và xicloankan
- Bài 28. Bài thực hành số 3 : Phân tích định tính nguyên tố. Điều chế và tính chất của metan
- Đề kiểm tra 15 phút - Chương V - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương V - Hóa học 11
CHƯƠNG 6: HIDROCACBON KHÔNG NO
- Bài 29. Anken
- Bài 30. Ankađien
- Bài 31. Luyện tập: Anken và Ankadien
- Bài 32. Ankin
- Bài 33. Luyện tập: Ankin
- Bài 34. Bài thực hành 4 : Điều chế và tính chất của etilen và axetilen
- Đề kiểm tra 15 phút - Chương VI - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương VI - Hóa học 11
CHƯƠNG 7: HIĐROCACBON THƠM, NGUỒN HIĐROCACBON THIÊN NHIÊN. HỆ THỐNG HÓA VỀ HIĐROCACBON
- Bài 35. Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
- Bài 36. Luyện tập: Hiđrocacbon thơm
- Bài 37. Nguồn Hiđrocacbon thiên nhiên
- Bài 38. Hệ thống hóa về hiđrocacbon
- Đề kiểm tra 15 phút - Chương VII - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương VII - Hóa học 11
CHƯƠNG 8: DẪN XUẤT HALOGEN - ANCOL - PHENOL
- Bài 39. Dẫn xuất halogen của hiđrocacbon
- Bài 40. Ancol
- Bài 41. Phenol
- Bài 42. Luyện tập: Dẫn xuất halogen, ancol và phenol
- Bài 43. Bài thực hành 5: Tính chất của etanol, glixerol và phenol
- Đề kiểm tra 15 phút - Chương VIII - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương VIII - Hóa học 11
CHƯƠNG 9: ANĐEHIT - XETON - AXIT CACBOXYLIC
- Bài 44. Anđehit - xeton
- Bài 45. Axit cacboxylic
- Bài 46. Luyện tập: Anđehit - xeton - axit cacboxylic
- Bài 47. Bài thực hành 6: Tính chất của anđehit và axit cacboxylic
- Đề kiểm tra 15 phút - Chương IX - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương IX - Hóa học 11
Xem Thêm
Lớp 11 | Các môn học Lớp 11 | Giải bài tập, đề kiểm tra, đề thi Lớp 11 chọn lọc
Danh sách các môn học Lớp 11 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2024 ngắn gọn, chi tiết dễ hiểu.
Toán Học
Vật Lý
Hóa Học
Ngữ Văn
- Soạn văn 11
- SBT Ngữ văn lớp 11
- Văn mẫu 11
- Soạn văn 11 chi tiết
- Soạn văn ngắn gọn lớp 11
- Soạn văn 11 siêu ngắn
Sinh Học
GDCD
Tin Học
Tiếng Anh
Công Nghệ
Lịch Sử & Địa Lý
- Tập bản đồ Địa lí lớp 11
- SBT Địa lí lớp 11
- SGK Địa lí lớp 11
- Tập bản đồ Lịch sử lớp 11
- SBT Lịch sử lớp 11
- SGK Lịch sử lớp 11