Lý thuyết về hợp chất của sắt
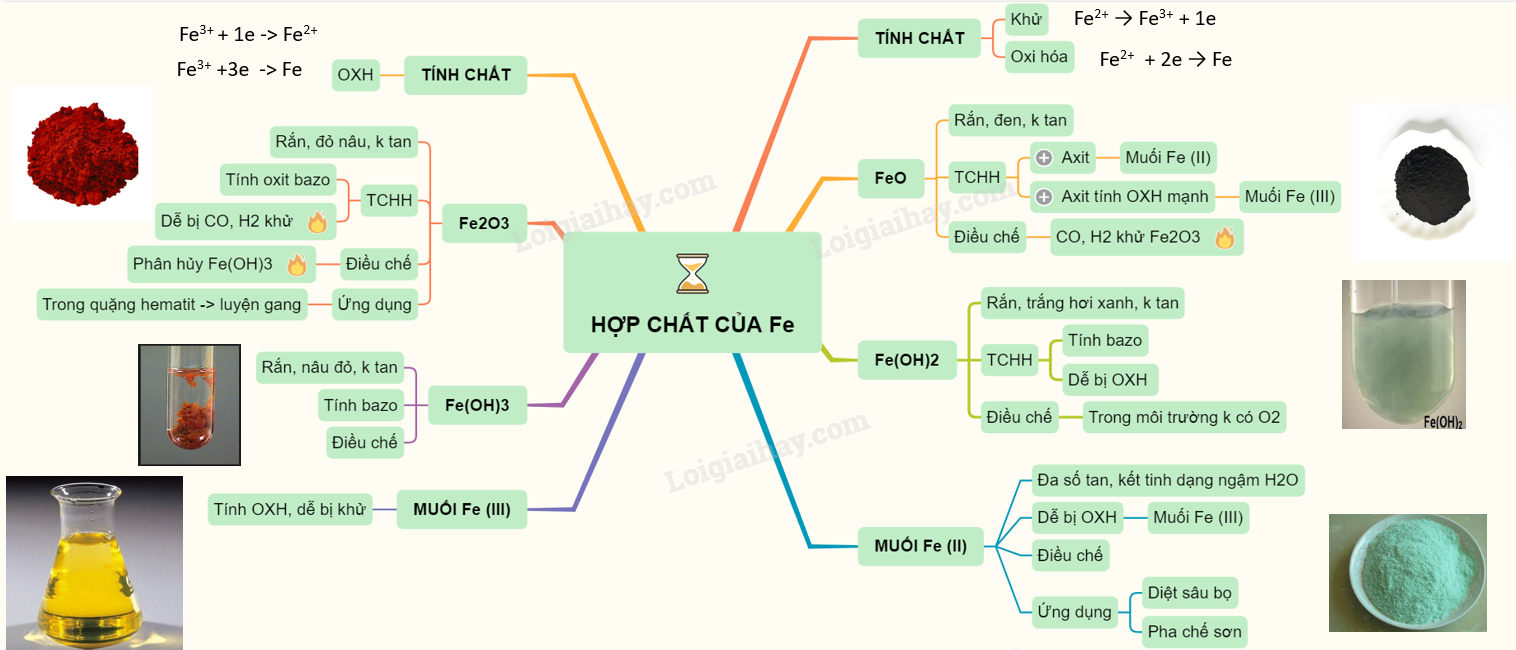
I. SẮT (II)
Có tính khử: Fe2+ \( \to\) Fe3+ + 1e và tính oxi hóa : Fe2+ + 2e \( \to\) Fe
1. Oxit FeO
- Chất rắn màu đen, không có trong tự nhiên, không tan trong nước
- Tác dụng được với axit sinh ra muối sắt (II) còn khi tác dụng với axit có tính oxi hóa mạnh thì thu được muối sắt (III)
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
- Điều chế bằng cách dùng CO hay H2 khử sắt (III) oxit ở 500oC
Fe2O3 + CO \(\xrightarrow{{{t^o}}}\) 2FeO + CO2
2. Hidroxit Fe(OH)2
- Là chất rắn, màu trắng hơi xanh, không tan trong nước.
- Dễ bị oxi hóa thành sắt (III) hiđroxit màu nâu đỏ trong không khí
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
- Có tính bazơ (tác dụng với axit (HCl, H2SO4 loãng) tạo nên muối sắt (II))
- Điều chế: trong môi trường không có oxi để thu được sản phẩm tinh khiết
3. Muối sắt (II)
- Đa số tan trong nước, khi kết tinh ở dạng ngậm nước.
- Dễ bị oxi hóa thành muối sắt (III)
2FeCl2 + Cl2 → 2FeCl3
- Chú ý: dung dịch muối sắt (II) điều chế được cần dùng ngay, vì trong không khí muối sắt (II) sẽ chuyển dần thành muối sắt (III).
- Điều chế: cho Fe (hoặc FeO, Fe(OH)2) tác dụng với HCl hoặc H2SO4 loãng:
Fe + 2HCl → FeCl2 + H2
FeO + H2SO4 → FeSO4 + H2
- Ứng dụng: muối FeSO4 được dùng làm chất diệt sâu bọ, pha chế sơn, mực nhuộm vải.
II. SẮT (III)
Có tính oxi hóa : tác dụng với một số kim loại, một số hợp chất có tính khử.
Fe3+ + 1e -> Fe2+ hoặc Fe3+ +3e -> Fe
1. Oxit Fe2O3
- Là chất rắn màu đỏ nâu, không tan trong nước
- Dễ tan trong cả dung dịch axit mạnh

- Ở nhiệt độ cao, Fe2O3 bị CO khử hoặc H2 khử thành Fe.
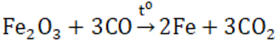
- Điều chế: qua phản ứng phân hủy sắt (III) hiđroxit ở nhiệt độ cao.

- Sắt (III) oxit tồn tại trong tự nhiên dưới dạng quặng hemantit dùng để luyện gang
2. Hidroxit Fe(OH)3
- Là chất rắn màu nâu đỏ, không tan trong nước nhưng dễ tan trong các dung dịch axit tạo muối sắt (III)
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
- Điều chế: cho dung dịch kiềm tác dụng với muối sắt (III).
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
3. Muối sắt (III)
- Các muối sắt (III) có tính oxi hóa, dễ bị khử thành muối sắt (II).
Fe + 2FeCl3 → 3FeCl2
- Bột đồng tan trong dung dịch muối sắt (III).
Cu + 2FeCl3 (vàng nâu) → CuCl2 + FeCl2
⇒ Dung dịch CuCl2 (màu xanh) và dung dịch FeCl2 (không màu) nên dung dịch thu được có màu xanh.
Sơ đồ tư duy: Hợp chất của sắt
Xemloigiai.com
- Bài 1 trang 145 SGK Hóa học 12
- Bài 2 trang 145 SGK Hóa học 12
- Bài 3 trang 145 SGK Hóa học 12
- Bài 4 trang 145 SGK Hóa học 12
- Bài 5 trang 145 SGK Hóa học 12
SGK Hóa lớp 12
Giải bài tập hóa học lớp 12 đầy đủ công thức, lý thuyết, phương trình hóa học, chuyên đề hóa học SGK 12 giúp để học tốt hóa học 12, giúp luyện thi THPT Quốc gia
CHƯƠNG 1. ESTE - LIPIT
- Bài 1. Este - Hóa học 12
- Bài 2. Lipit - Hóa học 12
- Bài 3. Khái niệm về xà phòng và chất giặt rửa tổng hợp
- Bài 4. Luyện tập este và chất béo
- Đề kiểm tra 15 phút - Chương 1 – Hóa học 12
- Đề kiểm tra 45 phút - Chương 1 – Hóa học 12
CHƯƠNG 2. CACBOHIDRAT
- Bài 5. Glucozơ - Hóa học 12
- Bài 6. Saccarozơ, tinh bột và xenlulozơ
- Bài 7. Luyện tập: Cấu tạo và tính chất của Cacbohiđrat
- Bài 8. Thực hành: Điều chế, tính chất hóa học của este và cacbohiđrat
- Đề kiểm tra 15 phút - Chương 2 - Hoá học 12
- Đề kiểm tra 45 phút - Chương 2 – Hóa học 12
CHƯƠNG 3. AMIN, AMINO AXIT VÀ PROTEIN
- Bài 9. Amin
- Bài 10. Amino axit
- Bài 11. Peptit và protein
- Bài 12. Luyện tập: Cấu tạo và tính chất của amin, amino axit và protein
- Đề kiểm tra 15 phút - Chương 3 – Hóa học 12
- Đề kiểm tra 45 phút - Chương 3 – Hóa học 12
CHƯƠNG 4. POLIME VÀ VẬT LIỆU POLIME
- Bài 13. Đại cương về polime
- Bài 14. Vật liệu polime
- Bài 15. Luyện tập: Polime và vật liệu polime
- Bài 16. Thực hành: Một số tính chất của protein và vật liệu polime
- Đề kiểm tra 15 phút – Chương 4 – Hóa học 12
- Đề kiểm tra 45 phút - Chương 4 – Hóa học 12
CHƯƠNG 5. ĐẠI CƯƠNG VỀ KIM LOẠI
- Bài 17. Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
- Bài 18. Tính chất của kim loại. Dãy điện hoá của kim loại
- Bài 19. Hợp kim
- Bài 20. Sự ăn mòn kim loại
- Bài 21. Điều chế kim loại
- Bài 22. Luyện tập: Tính chất của kim loại
- Bài 23. Luyện tập: Điều chế kim loại và sự ăn mòn kim loại
- Bài 24. Thực hành: Tính chất, điều chế kim loại, sự ăn mòn kim loại
- Đề kiểm tra 15 phút - Chương 5 – Hóa học 12
- Đề kiểm tra 45 phút - Chương 5 – Hóa học 12
Đề thi học kì 1 mới nhất có lời giải
CHƯƠNG 6. KIM LOẠI KIỀM, KIM LOẠI KIỀM THỔ, NHÔM
- Bài 25. Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
- Bài 26. Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ
- Bài 27. Nhôm và hợp chất của nhôm
- Bài 28. Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
- Bài 29. Luyện tập: Tính chất của nhôm và hợp chất của nhôm
- Bài 30. Thực hành: Tính chất của natri, magie, nhôm và hợp chất của chúng
- Đề kiểm tra 15 phút - Chương 6 – Hóa học 12
- Đề kiểm tra 45 phút (1 tiết ) – Chương 6 – Hóa học 12
CHƯƠNG 7. SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG
- Bài 31. Sắt
- Bài 32. Hợp chất của sắt
- Bài 33. Hợp kim của sắt
- Bài 34. Crom và hợp chất của Crom
- Bài 35. Đồng và hợp chất của đồng
- Bài 36. Sơ lược về Niken, Kẽm, Chì, Thiếc
- Bài 37. Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
- Bài 38. Luyện tập: Tính chất hóa học của Crom, đồng và hợp chất của chúng
- Bài 39. Thực hành: Tính chất hóa học của sắt, đồng và nhưng hợp chất của sắt, crom
- Đề kiểm tra 15 phút - Chương 7 – Hóa học 12
- Đề kiểm tra 45 phút (1 tiết ) – Chương 7 – Hóa học 12
CHƯƠNG 8. PHÂN BIỆT MỘT SỐ CHẤT VÔ CƠ
- Bài 40. Nhận biết một số ion trong dung dịch
- Bài 41. Nhận biết một số chất khí
- Bài 42. Luyện tập: Nhận biết một số chất vô cơ
- Đề kiểm tra 15 phút - Chương 8 – Hóa học 12
- Đề kiểm tra 45 phút (1 tiết ) – Chương 8 – Hóa học 12
CHƯƠNG 9. HÓA HỌC VÀ VẤN ĐỀ PHÁT TRIỂN KINH TẾ, XÃ HỘI, MÔI TRƯỜNG - HÓA 12
- Bài 43. Hóa học và vấn để phát triển kinh tế
- Bài 44. Hóa học và vấn đề xã hội
- Bài 45. Hóa học và vấn đề môi trường
- Đề kiểm tra 15 phút - Chương 9 – Hóa học 12
ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 12
Xem Thêm
- ĐỀ THI THỬ THPT QUỐC GIA MÔN HÓA HỌC
- Câu hỏi tự luyện Hóa 12
- Đề thi giữa kì 1 Hóa 12
- Đề kiểm tra giữa học kì II - Hóa học 12
- Đề thi thử THPTQG các trường
- Đề thi học kì 2 Hóa 12
- Đề thi giữa kì 2 Hóa 12
- Đề thi học kì 1 Hóa 12
- Đề thi giữa học kì 1 Hóa 12
- Đề kiểm tra 1 tiết Hóa 12
- Đề kiểm tra 15 phút Hóa 12
- Đề khảo sát chất lượng đầu năm Hóa 12
Lớp 12 | Các môn học Lớp 12 | Giải bài tập, đề kiểm tra, đề thi Lớp 12 chọn lọc
Danh sách các môn học Lớp 12 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2025 ngắn gọn, chi tiết dễ hiểu.
Toán Học
Vật Lý
Hóa Học
Ngữ Văn
- Soạn văn 12
- SBT Ngữ văn lớp 12
- Văn mẫu 12
- Soạn văn 12 chi tiết
- Soạn văn ngắn gọn lớp 12
- Soạn văn 12 siêu ngắn
Sinh Học
GDCD
Tin Học
Tiếng Anh
- SBT Tiếng Anh lớp 12
- Ngữ pháp Tiếng Anh
- SGK Tiếng Anh 12
- SBT Tiếng Anh lớp 12 mới
- SGK Tiếng Anh 12 Mới
Công Nghệ
Lịch Sử & Địa Lý
- Tập bản đồ Địa lí lớp 12
- SBT Địa lí lớp 12
- SGK Địa lí lớp 12
- Tập bản đồ Lịch sử lớp 12
- SBT Lịch sử lớp 12
- SGK Lịch sử lớp 12