Đề kiểm tra 45 phút (1 tiết) – Đề số 2 – Chương 4 – Hóa học 9
Đề bài
I.Trắc nghiệm khách quan (4 điểm: mỗi câu 0,5 điểm)
Câu 1: Tính chất hóa học đặc trưng của
A.metan là phản ứng thế và etilen là phản ứng cộng.
B.metan và etilen là phản ứng thế.
C.metan và etilen là phản ứng cộng.
D.metan và etilen là phản ứng cháy.
Câu 2: Metan và etilen có sự khác nhau về tính chất hóa học vì phân tử metan
A.chỉ có liên kết đơn còn với etilen ngoài liên kết đơn còn có liên kết đôi.
B.và etilen chỉ chứa 2 nguyên tố C và H.
C.chỉ có 1 nghuyên tử C còn phân tử etilen có 2 nguyên tử C.
D.chỉ có liên kết đơn còn với etilen chỉ có liên kết đôi.
Câu 3: Có thể dùng dung dịch Ca (OH)2, khí O2 để nhận biết các chất nào trong các chất sau: CH4, CO2, N2, H2 ?
A.CH4, N2, H2.
B. CH4, CO2, N2.
C. CO2, N2, H2.
D. CH4, CO2, H2.
Câu 4: Khi chi khí metan tác dụng với khí clo theo tỉ lệ 1:1 về thể tích, sản phẩm phản ứng là:
A.CCl4. B.CHCl3
C.CH2Cl2 D.CH3Cl.
Câu 5: Số công thức cấu tạo của C2H7N, C3H6 m(mạch hở) lần lượt là:
A.2, 1 B.1, 2
C.3, 1 D.3, 2.
Câu 6: Đốt cháy hoàn toàn 784ml khí ( đktc) một hidrocacbon X thu được 3,08 gam CO2 và 0,63 gam nước. Công thức phân tử của X là:
A.C2H4 B.C2H2
C.CH4 D.C6H6.
Câu 7: Dung dịch brom có thể phản ứng với tất cả các chất trong dãy nào sau đây?
\(\eqalign{ & A.C{H_3} - C{H_3},C{H_3} - CH = C{H_2},C{H_3} - C \equiv CH. \cr & B.C{H_3} - C{H_3},C{H_3} - CH = C{H_2},{C_6}{H_6}. \cr & C.C{H_3} - C{H_3},C{H_3} - C \equiv CH,{C_6}{H_6}. \cr & D.C{H_3} - CH = C{H_2},C{H_3} - C \equiv CH. \cr} \)
Câu 8: Đốt cháy 0,3 lít một chất hữu cơ Y (chỉ chứa 2 nguyên tố C, H) người ta thu được 0,6 lít CO2, 0,9 lít hơi H2O (các thể tích đo ở đktc). Công thức phân tử của Y là:
A.C2H6 B.C3H6
C.C3H4 D.C6H6.
II.Tự luận (6 điểm)
Câu 9 (2 điểm): Viết các công thức cấu tạo có thể có của C3H9N (biết C có hóa trị 4, H có hóa trị 1, N có hóa trị 3).
Câu 10 (2 điểm): Một hỗn hợp gồm metan và axetilen có thể tích 4,48 lít (đktc) sục vào dung dịch br2 dư. Dung dịch nặng thêm 3,9 gam.
Tìm thể tích khí O2 (đktc) cần để đốt cháy hết hỗn hợp trên (H = 1, C = 12).
Câu 11 (2 điểm): Một chất hữu cơ Z (chứa các nguyên tố C, H, Cl) trong đó thành phần % theo khối lượng của Cl là: 70,3%, của H là 5,94%.
Biết 0,1 mol chất này có khối lượng 5,05 gam.
Xác định công thức phân tử, công thức cấu tạo của Z (cho H = 1, C = 12, Cl = 35,5).
Lời giải chi tiết
1.Đáp án
Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Đáp án | A | A | B | D | A | B | D | A |
2.Lời giải
I.Trắc nghiệm khách quan (4 điểm: mỗi câu 0,5 điểm)
Câu 1: (A)
Do phân tử metan chỉ có liên kết đơn, còn phân tử etilen ngoài liên kết đơn còn có liên kết đôi kém bền nên dễ tham gia phản ứng cộng.
Câu 2: (A)
Số lượng nguyên tử của các nguyên tố ít ảnh hưởng đến tính chất hóa học (đều là các hidrocacbon)
Câu 3: (B)
Dùng dung dịch Ca(OH)2 nhận biết được CO2, nhưng với O2 không phân biệt được CH4, H2.
Câu 4: (D)
Với tỉ lệ 1:1 về thể tích ta có phương trình:
CH4 + Cl2 \(\to\) CH3Cl + HCl (ánh sáng)
Câu 5: (A)
Hai công thức cấu tạo của C2H7N là CH3 – CH2 – NH2 và CH3 – NH – CH3
C3H6 chỉ có 1 công thức cấu tạo mạch hở: CH2 = CH – CH3.
Câu 6: (B)
\(\eqalign{ & {m_C} = {{3,08.12} \over {44}} = 0,84gam,\cr&{m_H} = {{0,63.2} \over {18}} = 0,07gam \cr & \Rightarrow {m_X} = 0,91gam \cr & {n_X} = 0,035mol. \cr} \)
Vậy khối lượng phân tử MX = 26. Đó là C2H2.
Câu 7: (D)
Dung dịch brom không phản ứng với các chất trong ohaan tử chỉ có liên kết đơn, mạch hở, hay benzen C6H6.
Câu 8: (A)
\({C_x}{H_y} + (x + {y \over 4}){O_2} \to xC{O_2} + {y \over 2}{H_2}O\)
Ta có: \(\dfrac{1}{{0,3}} = \dfrac{x}{{0,6}} = \dfrac{y}{{2.0,9}}\Rightarrow x = 2,y = 6.\)
Công thức phân tử của Y là C2H6.
II.Tự luận (6 điểm)
Câu 9:
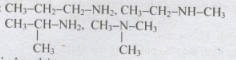
Viết đúng mỗi công thức 0,5 điểm
Câu 10:
\(\eqalign{ & {C_2}{H_2} + 2B{r_2} \to {C_2}{H_2}B{r_4} \cr & {m_{{C_2}{H_2}}} = 3,9 \cr& \Rightarrow {n_{{C_2}{H_2}}} = {{3,9} \over {26}} = 0,15mol \cr & {n_{C{H_4}}} = {{4,48} \over {22,4}} \cr & 2{C_2}{H_2} + 5{O_2} \to 4C{O_2} + 2{H_2}O \cr & C{H_4} + 2{O_2} \to C{O_2} + 2{H_2}O \cr & {n_{{O_2}}} = 0,15.2,5 + 0,05.2 \cr&\;\;\;\;\;\;\,= 0,375 + 0,1 = 0,475 \cr & {V_{{O_2}}} = 0,475.22,4 = 10,64\,l\,(đktc). \cr} \)
Câu 11:
Thành phần % theo khối lượng của C là:
\(\eqalign{ & 100 - (70,3 + 5,94) = 23,76 \cr & {n_C}:{n_H}:{n_{Cl}} = 1,98:5,94:1,98 = 1:3:1 \cr} \)
Công thức đơn giản nhất: CH3Cl
Công thức phân tử (CH3Cl)n
Mặt khác: \(M = 5,05:0,1 = 50,5\)
Mà M = (12+3+35,5)n
\( \Rightarrow n = 1 \Rightarrow \) Z là CH3Cl
Công thức cấu tạo của Z: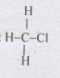
Xemloigiai.com
- Đề kiểm tra 45 phút (1 tiết) – Đề số 1 – Chương 4 – Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) – Đề số 3 – Chương 4 – Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) – Đề số 4 – Chương 4 – Hóa học 9
SGK Hóa lớp 9
Giải bài tập hóa học lớp 9 đầy đủ công thức, lý thuyết, phương trình hóa học, chuyên đề hóa học SGK 9 giúp để học tốt hóa học 9
CHƯƠNG 1: CÁC LOẠI HỢP CHẤT VÔ CƠ
- Bài 1. Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
- Bài 2. Một số oxit quan trọng
- Bài 3. Tính chất hóa học của axit
- Bài 4. Một số axit quan trọng
- Bài 5. Luyện tập: Tính chất hóa học của oxit và axit
- Bài 6. Thực hành: Tính chất hóa học của oxit và axit
- Bài 7. Tính chất hóa học của bazơ
- Bài 8. Một số bazơ quan trọng
- Bài 9. Tính chất hóa học của muối
- Bài 10. Một số muối quan trọng
- Bài 11. Phân bón hóa học
- Bài 12. Mối quan hệ giữa các loại chất vô cơ
- Bài 13. Luyện tập chương 1: Các hợp chất vô cơ
- Bài 14. Thực hành: Tính chất hóa học của bazơ và muối
- Đề kiểm tra 15 phút - Chương 1 - Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) - Chương 1 - Hóa học 9
Đề thi giữa học kì - Hóa học 9
CHƯƠNG 2: KIM LOẠI
- Bài 15. Tính chất vật lí của kim loại
- Bài 16. Tính chất hoá học của kim loại
- Bài 17. Dãy hoạt động hoá học của kim loại
- Bài 18. Nhôm
- Bài 19. Sắt
- Bài 20. Hợp kim sắt: Gang, thép
- Bài 21. Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- Bài 22. Luyện tập chương 2: Kim loại
- Bài 23. Thực hành: Tính chất hóa học của nhôm và sắt
- Bài 24. Ôn tập học kì 1
- Đề kiểm tra 15 phút - Chương 2 - Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) - Chương 2 - Hóa học 9
Đề thi học kì 1 mới nhất có lời giải
CHƯƠNG 3: SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
- Bài 25. Tính chất của phi kim
- Bài 26. Clo
- Bài 27. Cacbon
- Bài 28. Các oxit của cacbon
- Bài 29. Axit cacbonic và muối cacbonat
- Bài 30. Silic. Công nghiệp silicat.
- Bài 31. Sơ lược về bảng tuần hoàn các nguyên tố hoá học
- Bài 32. Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hoá học
- Bài 33. Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng
- Đề kiểm tra 15 phút - Chương 3 – Hóa học 9
CHƯƠNG 4: HIĐROCACBON. NHIÊN LIỆU
- Bài 34. Khái niệm về hợp chất hữu cơ và hoá học hữu cơ
- Bài 35. Cấu tạo phân tử hợp chất hữu cơ
- Bài 36. Metan
- Bài 37. Etilen
- Bài 38. Axetilen
- Bài 39. Benzen
- Bài 40. Dầu mỏ và khí thiên nhiên
- Bài 41. Nhiên liệu
- Bài 42. Luyện tập chương 4: Hiđrocacbon. Nhiên liệu
- Bài 43. Thực hành: Tính chất của Hiđrocacbon
- Đề kiểm tra 15 phút - Chương 4 - Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Hóa học 9
CHƯƠNG 5: DẪN XUẤT CỦA HIĐROCACBON. POLIME
- Bài 44. Rượu etylic
- Bài 45. Axit axetic
- Bài 46. Mối liên hệ giữa etilen, rượu etylic và axit axetic
- Bài 47. Chất béo
- Bài 48. Luyện tập rượu etylic, axit axetic và chất béo
- Bài 49. Thực hành: Tính chất của rượu và axit
- Bài 50. Glucozơ
- Bài 51. Saccarozơ
- Bài 52. Tinh bột và xenlulozơ
- Bài 53. Protein
- Bài 54. Polime
- Bài 55. Thực hành: Tính chất của gluxit
- Bài 56. Ôn tập cuối năm - Hóa học 9
- Đề kiểm tra 15 phút - Chương 5 - Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) - Chương 5 - Hóa học 9
Xem Thêm
Lớp 9 | Các môn học Lớp 9 | Giải bài tập, đề kiểm tra, đề thi Lớp 9 chọn lọc
Danh sách các môn học Lớp 9 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2025 ngắn gọn, chi tiết dễ hiểu.
Toán Học
Vật Lý
Hóa Học
Ngữ Văn
- SBT Ngữ văn lớp 9
- Đề thi vào 10 môn Văn
- Tác giả - Tác phẩm văn 9
- Văn mẫu lớp 9
- Vở bài tập Ngữ văn lớp 9
- Soạn văn 9 chi tiết
- Soạn văn 9 ngắn gọn
- Soạn văn 9 siêu ngắn
Sinh Học
GDCD
Tin Học
Tiếng Anh
- SBT Tiếng Anh lớp 9
- Đề thi vào 10 môn Anh
- SGK Tiếng Anh lớp 9
- SBT Tiếng Anh lớp 9 mới
- Vở bài tập Tiếng Anh 9
- SGK Tiếng Anh lớp 9 Mới
Công Nghệ
Lịch Sử & Địa Lý
- Tập bản đồ Địa lí lớp 9
- SBT Địa lí lớp 9
- VBT Địa lí lớp 9
- SGK Địa lí lớp 9
- Tập bản đồ Lịch sử lớp 9
- SBT Lịch sử lớp 9
- VBT Lịch sử lớp 9
- SGK Lịch sử lớp 9