Bài 6. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm trang 15, 16, 17 SBT Hóa 10 Kết nổi tri thức
6.1
Đại lượng nào sau đây trong nguyên tử của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
A. Số lớp electron.
B. Số electron ở lớp ngoài cùng.
C. Nguyên tử khối.
D. Số electron trong nguyên tử.
Phương pháp giải:
Dựa vào sau mỗi chu kì, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A lặp đi lặp lại một cách tuần hoàn
Lời giải chi tiết:
Đáp án: B
6.2
Cấu hình electron hóa trị của nguyên tử các nguyên tố nhóm IIA trong bảng tuần hoàn đều là
A. np2.
B. ns2.
C. ns2np2.
D. ns2np4.
Phương pháp giải:
Dựa vào: số thứ tự nhóm = số electron lớp ngoài cùng
Lời giải chi tiết:
Đáp án: B
6.3
Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử,
A. bán kính nguyên tử và độ âm điện đều giảm.
B. bán kính nguyên tử và độ âm điện đều tăng.
C. bán kính nguyên tử tăng, độ âm điện giảm.
D. bán kính nguyên tử giảm, độ âm điện tăng.
Phương pháp giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Xu hướng biến đổi độ âm điện:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
Lời giải chi tiết:
Đáp án: D
6.4
Nguyên tố Y thuộc chu kì 4, nhóm IA của bảng tuần hoàn. Phát biểu nào sau đây về Y là đúng?
A. Y có độ âm điện lớn nhất và bán kính nguyên tử lớn nhất trong chu kì 4.
B. Y có độ âm điện lớn nhất và bán kính nguyên tử nhỏ nhất trong chu kì 4.
C. Y có độ âm điện nhỏ nhất và bán kính nguyên tử lớn nhất trong chu kì 4.
D. Y có độ âm điện nhỏ nhất và bán kính nguyên tử nhỏ nhất trong chu kì 4.
Phương pháp giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Xu hướng biến đổi độ âm điện:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
Lời giải chi tiết:
- Y thuộc nhóm IA => Y đứng đầu chu kì
=> Đáp án: C
6.5
Trong một nhóm A (trừ nhóm VIIIA), theo chiều tăng của điện tích hạt nhân nguyên tử,
A. tính kim loại tăng dần, độ âm điện tăng dần.
B. tính phi kim giảm dần, bán kính nguyên tử tăng dần.
C. độ âm điện giảm dần, tính phi kim tăng dần.
D. tính kim loại tăng dần, bán kính nguyên tử giảm dần.
Phương pháp giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Xu hướng biến đổi độ âm điện:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
- Xu hướng biến đổi tính kim loại, tính phi kim:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần
Lời giải chi tiết:
Đáp án: B
6.6
Phát biểu nào sau đây không đúng?
A. Nguyên tử có Z = 11 có bán kính nhỏ hơn nguyên tử có Z = 19.
B. Nguyên tử có Z = 12 có bán kính lớn hơn nguyên tử có Z = 10.
C. Nguyên tử có Z = 11 có bán kính nhỏ hơn nguyên tử có Z = 13.
D. Các nguyên tố kim loại kiềm có bán kính nguyên tử lớn nhất trong chu kì.
Phương pháp giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào các xu hướng biến đổi để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
+ Nguyên tố có Z = 10 => Cấu hình electron là: 1s22s22p6
=> Nguyên tố này thuộc chu kì 2, nhóm VIIIA
+ Nguyên tố có Z = 11 => Cấu hình electron là: 1s22s22p63s1
=> Nguyên tố này thuộc chu kì 3, nhóm IA
+ Nguyên tố có Z = 12 => Cấu hình electron là: 1s22s22p63s2
=> Nguyên tố này thuộc chu kì 3, nhóm IIA
+ Nguyên tố có Z = 13 => Cấu hình electron là: 1s22s22p63s23p1
=> Nguyên tố này thuộc chu kì 3, nhóm IIIA
+ Nguyên tố có Z = 19 => Cấu hình electron là: 1s22s22p63s23p64s1
=> Nguyên tố này thuộc chu kì 4, nhóm IA

- Bước 2: Dựa vào xu hướng biến đổi bán kính nguyên tử:
+ Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử là: Z = 11 < Z = 19
+ Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử là: Z = 13 < Z = 11
=> Đáp án: C
6.7
Cho các nguyên tố sau: Li, Na, K, Ca. Nguyên tử của nguyên tố có bán kính bé nhất là
A. Li.
B. Na.
C. K.
D. Cs.
Phương pháp giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào các xu hướng biến đổi để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
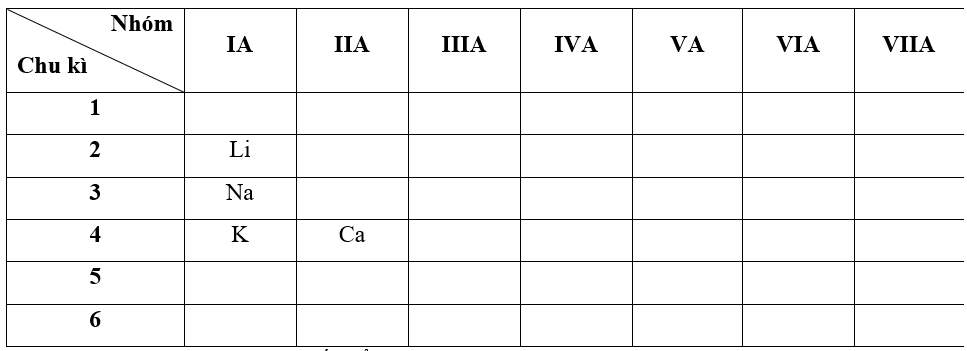
- Bước 2: Dựa vào xu hướng biến đổi bán kính nguyên tử:
+ Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử của các nguyên tố là: Li < Na < K
+ Trong cùng một chu kì 4, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử của các nguyên tố là: Ca < K
=> Nguyên tử của nguyên tố có bán kính bé nhất là Li (Do Ca ở chu kì 4 nên có 4 lớp electron " bán kính nguyên tử sẽ lớn hơn so với Li ở chu kì 2 chỉ có 2 lớp electron)
=> Đáp án: D
6.8
Phát biểu nào sau đây không đúng?
A. Nguyên tử có bán kính nhỏ nhất có Z = 1.
B. Kim loại yếu nhất trong nhóm IA có Z = 3.
C. Nguyên tố có độ âm điện lớn nhất có Z = 9.
D. Phi kim mạnh nhất trong nhóm VA có Z = 7.
Phương pháp giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Xu hướng biến đổi tính kim loại, tính phi kim:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần
- Xu hướng biến đổi độ âm điện:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
Lời giải chi tiết:
Đáp án: A. Sai vì nguyên tử có bán kính nhỏ nhất nằm ở cuối chu kì 2 và ở đầu nhóm VIIA là F (Z = 9)
6.9
Thứ tự tăng dần bán kính nguyên tử là
A. Li, Be, F, Cl.
B. Be, Li, F, Cl.
C. F, Be, Li, Cl.
D. Cl, F, Li, Be.
Phương pháp giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào các xu hướng biến đổi để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi bán kính nguyên tử:
+ Trong cùng một nhóm VIIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử của các nguyên tố là: F < Cl
+ Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử của các nguyên tố là: F < Be < Li
=> Dựa vào dữ kiện các đáp án có => Đáp án: C
6.10
Cho các nguyên tố sau 3Li, 8O, 9F, 11Na. Dãy gồm các nguyên tổ được sắp xếp theo chiều tăng dần bán kính nguyên tử từ trái sang phải là
A. F, O, Li, Na.
B. F, Na, O, Li.
C. F, Li, O, Na.
D. Li, Na, O, F
Phương pháp giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào các xu hướng biến đổi để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn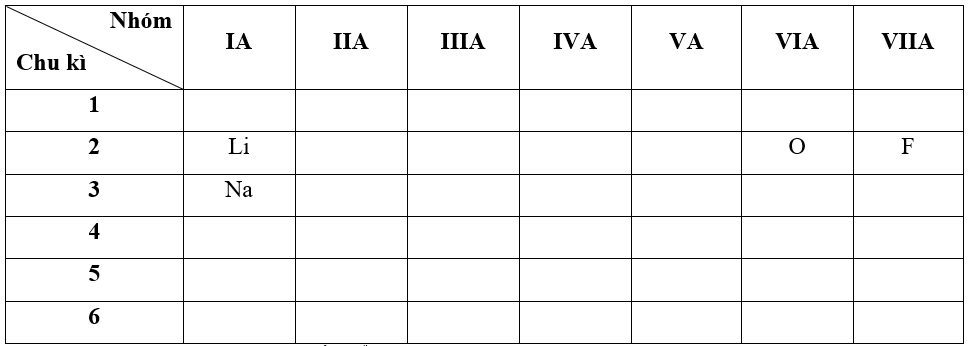
- Bước 2: Dựa vào xu hướng biến đổi bán kính nguyên tử:
+ Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử của các nguyên tố là: Li < Na (1)
+ Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử của các nguyên tố là: F < O < Li (2)
=> Từ (1) và (2) ta có dãy sắp xếp theo chiều tăng bán kính nguyên tử:
F < O < Li < Na
6.11
Cho các nguyên tố sau: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là
A. N, Si, Mg, K.
B. Mg, K, Si, N.
C. K, Mg, N, Si.
D. K, Mg, Si, N.
Phương pháp giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào các xu hướng biến đổi để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn

- Bước 2: Dựa vào xu hướng biến đổi bán kính nguyên tử:
Do nguyên tố K và Mg không có cùng chu kì và cũng không cùng nhóm nên ta so sánh thông qua nguyên tố trung gian là Na (Na cùng chu kì với Mg và cùng nhóm với K)
+ Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần bán kính nguyên tử của các nguyên tố là: K > Na (1)
+ Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần bán kính nguyên tử của các nguyên tố là: Na > Mg > Si (2)
Do nguyên tố Si và N không có cùng chu kì và cũng không cùng nhóm nên ta so sánh thông qua nguyên tố trung gian là C (C cùng chu kì với N và cùng nhóm với Si)
+ Trong cùng một nhóm IVA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần bán kính nguyên tử của các nguyên tố là: Si > C (3)
+ Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần bán kính nguyên tử của các nguyên tố là: C > N (4)
=> Từ (1), (2), (3) và (4) ta có dãy sắp xếp theo chiều giảm dần bán kính nguyên tử:
K > Na > Mg > Si > C > N
=> Đáp án: D
6.12
Độ âm điện của các nguyên tố Mg, Al, B và N xếp theo chiều tăng dần là
A. Mg < B < Al < N.
B. Mg < Al < B < N.
C. B < Mg < Al < N.
D. Al < B < Mg < N.
Phương pháp giải:
- Xu hướng biến đổi độ âm điện:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào các xu hướng biến đổi để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn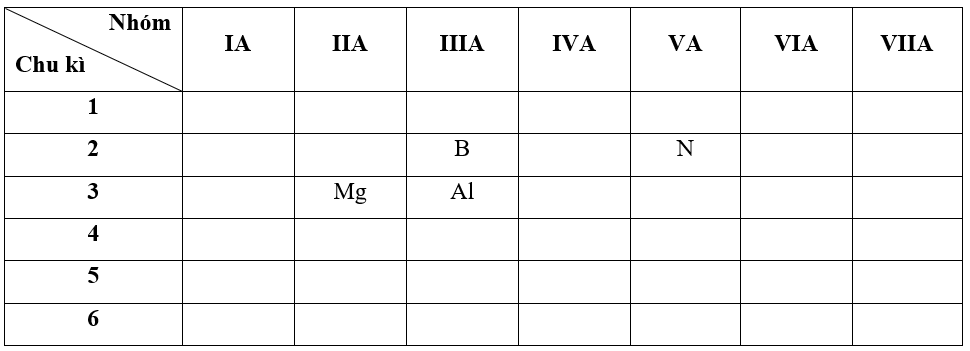
- Bước 2: Dựa vào xu hướng biến đổi độ âm điện:
+ Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện của các nguyên tố là: Mg < Al (1)
+ Trong cùng một nhóm IIIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện của các nguyên tố là: Al < B (2)
+ Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện của các nguyên tố là: B < N (1)
=> Từ (1), (2) và (3) ta có dãy sắp xếp theo chiều tăng bán kính nguyên tử:
Mg < Al < B < N
=> Đáp án: B
6.13
Độ âm điện của các nguyên tố F, Cl, Br và I xếp theo chiều giảm dần là
A. Cl > F > I > Br.
B. I > Br > Cl > F.
C. F > Cl > Br > I.
D. I > Br > F > Cl.
Phương pháp giải:
- Xu hướng biến đổi độ âm điện:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào các xu hướng biến đổi để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi độ âm điện:
+ Trong cùng một nhóm VIIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần độ âm điện của các nguyên tố là: F > Cl > Br > I
=> Đáp án: C
6.14
Nguyên tử của nguyên tố X có bán kính rất lớn. Phát biểu nào sau đây về X là đúng?
A. Độ âm điện của X rất lớn và X là phi kim.
B. Độ âm điện của X rất nhỏ và X là phi kim.
C. Độ âm điện của X rất lớn và X là kim loại.
D. Độ âm điện của X rất nhỏ và X là kim loại
Phương pháp giải:
- Xu biến đổi bán kính nguyên tử tỉ lệ nghịch với xu hướng biến đổi độ âm điện
- Nguyên tố có độ âm điện càng nhỏ thì tính kim loại càng cao, tính phi kim càng thấp và ngược lại
Lời giải chi tiết:
Đáp án: D
6.15
Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt là 6, 9, 14. Thứ tự tính phi kim tăng dần của các nguyên tố đó là
A. X < Z < Y.
B. Z < X < Y.
C. Z < Y < X.
D. Y < X < Z.
Phương pháp giải:
- Xu hướng biến đổi tính kim loại, tính phi kim:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
+ Nguyên tố X có Z = 6 => Cấu hình electron của X là: 1s22s22p2
=> X thuộc chu kì 2, nhóm IVA
+ Nguyên tố Y có Z = 9 => Cấu hình electron của Y là: 1s22s22p5
=> Y thuộc chu kì 2, nhóm VIIA
+ Nguyên tố Z có Z = 14 => Cấu hình electron của Z là: 1s22s22p63s23p2
=> Z thuộc chu kì 3, nhóm IVA
- Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim
+ Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính phi kim là: X < Y (1)
+ Trong cùng một nhóm IVA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính phi kim là: Z < X (2)
=> Từ (1) và (2) ta có dãy sắp xếp theo chiều tăng dần tính phi kim:
Z < X < Y
=> Đáp án: B
6.16
Dãy nguyên tố nào sau đây được xếp theo chiều tăng dần tính phi kim?
A. N, P, As, Bi.
B. F, Cl, Br, I.
C. C, Si, Ge, Sn.
D. Te, Se, S, O.
Phương pháp giải:
- Xu hướng biến đổi tính kim loại, tính phi kim:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim
+ Trong cùng một nhóm IVA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính phi kim là: Sn < Ge < Si < C
+ Trong cùng một nhóm VA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính phi kim là: Bi < As < P < N
+ Trong cùng một nhóm VIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính phi kim là: Te < Se < S < O
+ Trong cùng một nhóm VIIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính phi kim là: I < Br < Cl < F
=> Đáp án: D
6.17
Trong bảng tuần hoàn, hai nguyên tố X và Y có cùng số thứ tự nhóm. X thuộc nhóm A và Y thuộc nhóm B. So sánh số electron hóa trị và tính chất của X, Y. Minh hoạ bằng nguyên tố Cl và Mn ở nhóm VII.
Phương pháp giải:
- Các nguyên tố cùng một nhóm thì số electron hóa trị sẽ giống nhau
- Các nguyên tố nhóm A có electron hóa trị cuối cùng điền vào phân lớp s hoặc p
- Các nguyên tố nhóm B có electron hóa trị cuối cùng điền vào phân lớp d hoặc f
Lời giải chi tiết:
- Giống nhau: trong cùng nhóm, các nguyên tử của nguyên tố nhóm A và B đều có số electron hóa trị bằng nhau => hóa trị cao nhất bằng nhau
- Khác nhau:
+ Các nguyên tố nhóm A có electron hóa trị cuối cùng điền vào phân lớp s hoặc p
+ Các nguyên tố nhóm B có electron hóa trị cuối cùng điền vào phân lớp d hoặc f
=> Tính chất vật lý và hóa học khác nhau
- Ví dụ:
Đặc điểm so sánh | Chlorine (Z=17) | Manganese (Z = 25) |
Cấu hình electron | [Ne]3s23p5 | [Ar]3d54s2 |
Hóa trị cao nhất | VII | VII |
Electron hóa trị cuối cùng điền vào phân lớp | p | d |
Tính chất hóa học | Phi kim | Kim loại chuyển tiếp |
Trạng thái tồn tại | Chất khí | Chất rắn |
6.18
Cho cấu hình electron của nguyên tử hai nguyên tố sau:
X: 1s22s22p63s23p3, Y: 1s22s22p63s23p63d34s2.
a) X, Y có ở trong cùng một nhóm nguyên tố không? Giải thích
b) X, Y cách nhau bao nhiêu nguyên tố hoá học? Có cùng chu kì không?
Phương pháp giải:
Dựa vào
- Từ cấu hình electron của nguyên tử => các dữ kiện cần thiết
+ Số lớp electron = số chu kì
+ Số electron lớp ngoài cùng = số nhóm
+ Ô số thứ tự = điện tích hạt nhân = số proton = số electron
- Cách xác định nhóm của các nguyên tố nhóm B có cấu hình electron lớp ngoài cùng là (n-1)dxnsy
+ TH1: 3 ≤ (x+y) ≤ 7 => Nguyên tố thuộc nhóm (x+y)B
+ TH2: 8 ≤ (x+y) ≤ 10 => Nguyên tố thuộc nhóm VIIIB
+ TH3: 11 ≤ (x+y) ≤ 12 => Nguyên tố thuộc nhóm (x+y-10)B
Lời giải chi tiết:
a) - Cấu hình electron của X: 1s22s22p63s23p3
=> Đây là nguyên tố phosphorus (P) thuộc chu kì 3, nhóm VA, ô 15 trong bảng tuần hoàn
- Cấu hình electron của Y: 1s22s22p63s23p63d34s2
=> Đây là nguyên tố vanadium (V) thuộc chu kì 4, nhóm VB, ô 23 trong bảng tuần hoàn
=> X và Y không cùng trong 1 nhóm nguyên tố
b) - X và Y không thuộc cùng chu kì (X thuộc chu kì 3, Y thuộc chu kì 4)
- X và Y cách nhau 8 nguyên tố hóa học
6.19
Cho các nguyên tố sau: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Hãy sắp xếp các nguyên tố trên theo chiều giảm dần bán kính nguyên tử.
Phương pháp giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
+ Nguyên tố N có Z = 7 => Cấu hình electron của N là: 1s22s22p3
=> N thuộc chu kì 2, nhóm VA
+ Nguyên tố Mg có Z = 12 => Cấu hình electron của Mg là: 1s22s22p63s2
=> Mg thuộc chu kì 3, nhóm IIA
+ Nguyên tố Si có Z = 14 => Cấu hình electron của Si là: 1s22s22p63s23p2
=> Si thuộc chu kì 3, nhóm IVA
+ Nguyên tố K có Z = 19 => Cấu hình electron của K là: 1s22s22p63s23p64s1
=> K thuộc chu kì 4, nhóm IA
- Bước 2: Dựa vào xu hướng biến đổi bán kính nguyên tử:
Do nguyên tố K và Mg không có cùng chu kì và cũng không cùng nhóm nên ta so sánh thông qua nguyên tố trung gian là Na (Na cùng chu kì với Mg và cùng nhóm với K)
+ Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần bán kính nguyên tử của các nguyên tố là: K > Na (1)
+ Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần bán kính nguyên tử của các nguyên tố là: Na > Mg > Si (2)
Do nguyên tố Si và N không có cùng chu kì và cũng không cùng nhóm nên ta so sánh thông qua nguyên tố trung gian là C (C cùng chu kì với N và cùng nhóm với Si)
+ Trong cùng một nhóm IVA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần bán kính nguyên tử của các nguyên tố là: Si > C (3)
+ Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần bán kính nguyên tử của các nguyên tố là: C > N (4)
=> Từ (1), (2), (3) và (4) ta có dãy sắp xếp theo chiều giảm dần bán kính nguyên tử:
K > Mg > Si > N
6.20
Cho các nguyên tố X, Y, Z và T với số hiệu nguyên tử lần lượt là 9, 17, 33 và 35. Hãy sắp xếp thứ tự tăng dần độ âm điện và giải thích.
Phương pháp giải:
- Xu hướng biến đổi độ âm điện:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào các xu hướng biến đổi để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
+ Nguyên tố X có Z = 9 => Cấu hình electron của X là: 1s22s22p5
=> X thuộc chu kì 2, nhóm VIIA
+ Nguyên tố Y có Z = 17 => Cấu hình electron của Y là: 1s22s22p63s23p5
=> Y thuộc chu kì 3, nhóm VIIA
+ Nguyên tố Z có Z = 33 => Cấu hình electron của Z là: 1s22s22p63s23p63d104s24p3
=> Z thuộc chu kì 4, nhóm VA
+ Nguyên tố T có Z = 35 => Cấu hình electron của T là: 1s22s22p63s23p63d104s24p5
=> T thuộc chu kì 4, nhóm VIIA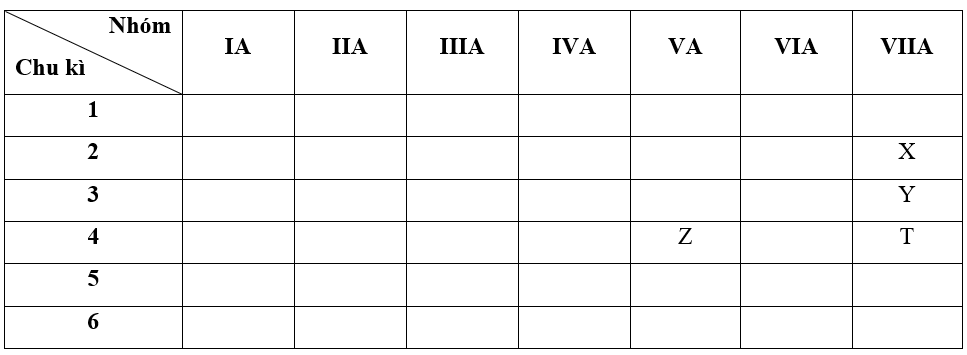
- Bước 2: Dựa vào xu hướng biến đổi độ âm điện:
+ Trong cùng một nhóm VIIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện là: T < Y < X (1)
+ Trong cùng một chu kì 4, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện là: Z < T (2)
=> Từ (1) và (2) ta có dãy sắp xếp theo chiều tăng dần độ âm điện: Z < T < Y < X
6.21
Cho các nguyên tố cùng thuộc chu kì 3: 11Na, 13A1 và 17Cl và các giá trị độ âm điện là: 3,16; 1,61; 0,93. Hãy gán mỗi giá trị độ âm điện cho mỗi nguyên tố và giải thích.
Phương pháp giải:
- Xu hướng biến đổi độ âm điện:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào các xu hướng biến đổi để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
- Bước 2: Dựa vào xu hướng biến đổi độ âm điện:
+ Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần độ âm điện là: Na < Al < Cl
=> Độ âm điện của các nguyên tố Na, Al và Cl lần lượt là: 0,93; 1,61 và 3,16
6.22
Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt là 6, 9, 14.
a) Xác định vị trí của các nguyên tố đó trong bảng tuần hoàn.
b) Xếp các nguyên tố đó theo thứ tự bán kính nguyên tử tăng dần.
c) Xếp các nguyên tố đó theo thứ tự độ âm điện giảm dần.
d) Xếp các nguyên tố đó theo thứ tự tính phi kim tăng dần.
Phương pháp giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Xu hướng biến đổi độ âm điện:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
- Xu hướng biến đổi tính kim loại, tính phi kim:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim để xác định đáp án đúng
Lời giải chi tiết:
a) - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
+ Nguyên tố X có Z = 6 => Cấu hình electron của X là: 1s22s22p2
=> X thuộc chu kì 2, nhóm IVA
+ Nguyên tố Y có Z = 9 => Cấu hình electron của Y là: 1s22s22p5
=> Y thuộc chu kì 2, nhóm VIIA
+ Nguyên tố Z có Z = 14 => Cấu hình electron của Z là: 1s22s22p63s23p2
=> Z thuộc chu kì 3, nhóm IVA
b + c + d)
- Bước 2: Dựa vào các xu hướng biến đổi
+ Xu hướng biến đổi bán kính nguyên tử
Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử là: Y < X (1)
Trong cùng một nhóm IVA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính bán kính nguyên tử là: X < Z (2)
=> Từ (1) và (2) ta có dãy sắp xếp theo chiều tăng dần bán kính nguyên tử:
Y < X < Z
+ Xu hướng biến đổi độ âm điện
Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần độ âm điện là: Y > X (3)
Trong cùng một nhóm IVA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần độ âm điện là: X > Z (4)
=> Từ (3) và (4) ta có dãy sắp xếp theo chiều giảm dần độ âm điện:
Y > X > Z
+ Xu hướng biến đổi tính kim loại, tính phi kim
Trong cùng một chu kì 2, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính phi kim là: X < Y (5)
Trong cùng một nhóm IVA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính phi kim là: Z < X (6)
=> Từ (5) và (6) ta có dãy sắp xếp theo chiều tăng dần tính phi kim:
Z < X < Y
6.23
Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt là 11, 13, 19.
a) Xác định vị trí của các nguyên tố đó trong bảng tuần hoàn.
b) Xếp các nguyên tố đó theo thứ tự bán kính nguyên tử tăng dần.
c) Gán các giá trị độ âm điện (0,82 ; 1,31 và 0,93) cho X, Y, Z.
d) Xếp các nguyên tố đó theo thứ tự tính kim loại giảm dần.
Phương pháp giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
- Xu hướng biến đổi độ âm điện:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
- Xu hướng biến đổi tính kim loại, tính phi kim:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim để xác định đáp án đúng
Lời giải chi tiết:
a) - Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
+ Nguyên tố X có Z = 11 => Cấu hình electron của X là: 1s22s22p63s1
=> X thuộc chu kì 3, nhóm IA
+ Nguyên tố Y có Z = 13 => Cấu hình electron của Y là: 1s22s22p63s23p1
=> Y thuộc chu kì 3, nhóm IIIA
+ Nguyên tố Z có Z = 19 => Cấu hình electron của Z là: 1s22s22p63s23p64s1
=> Z thuộc chu kì 4, nhóm IA
b + c + d) - Bước 2: Dựa vào các xu hướng biến đổi
- Bước 2: Dựa vào các xu hướng biến đổi
+ Xu hướng biến đổi bán kính nguyên tử
Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử là: Y < X (1)
Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính bán kính nguyên tử là: X < Z (2)
=> Từ (1) và (2) ta có dãy sắp xếp theo chiều tăng dần bán kính nguyên tử:
Y < X < Z
+ Xu hướng biến đổi độ âm điện
Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần độ âm điện là: Y > X (3)
Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần độ âm điện là: X > Z (4)
=> Từ (3) và (4) ta có dãy sắp xếp theo chiều giảm dần độ âm điện:
Y > X > Z
=> Độ âm điện của các nguyên tố Y, X và Z lần lượt là: 1,31; 0,93 và 0,82
+ Xu hướng biến đổi tính kim loại, tính phi kim
Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần tính kim loại là: X > Y (5)
Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần tính kim loại là: Z > X (6)
=> Từ (5) và (6) ta có dãy sắp xếp theo chiều giảm dần tính kim loại:
Z > X > Y
6.24
So sánh tính kim loại của các nguyên tố: Al, Ca, Rb.
Phương pháp giải:
- Xu hướng biến đổi tính kim loại, tính phi kim:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần
- Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim để xác định đáp án đúng
Lời giải chi tiết:
- Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn - Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim
- Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim
Do nguyên tố Rb và Ca không có cùng chu kì và cũng không cùng nhóm nên ta so sánh thông qua nguyên tố trung gian là K (K cùng chu kì với Ca và cùng nhóm với Rb)
+ Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính kim loại của các nguyên tố là: K < Rb (1)
+ Trong cùng một chu kì 4, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính kim loại của các nguyên tố là: Ca < K (2)
Do nguyên tố Ca và Al không có cùng chu kì và cũng không cùng nhóm nên ta so sánh thông qua nguyên tố trung gian là Mg (Mg cùng chu kì với Al và cùng nhóm với Ca)
+ Trong cùng một nhóm IIA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính kim loại của các nguyên tố là: Mg < Ca (3)
+ Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính kim loại của các nguyên tố là: Al < Mg (4)
=> Từ (1), (2), (3) và (4) ta có dãy sắp xếp theo chiều tăng dần tính kim loại:
Al < Mg < Ca < K < Rb
=> Vậy tính kim loại của 3 nguyên tố Al, Ca, Rb xếp theo chiều tăng dần tính kim loại là Al < Ca < Rb
- Bài 5. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học trang 13, 14 SBT Hóa 10 Kết nổi tri thức
- Bài 7. Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì trang 18, 19, 20 SBT Hóa 10 Kết nối tri thức với cuộc sống
- Bài 8. Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học trang 21, 22, 23 SBT Hóa 10 Kết nối tri thức với cuộc sống
- Bài 9. Ôn tập chương 2 trang 24, 25, 26 SBT Hóa 10 Kết nối tri thức với cuộc sống
SBT Hóa 10 - Kết nối tri thức
Để học tốt SBT Hóa 10 - Kết nối tri thức, loạt bài giải bài tập SBT Hóa 10 - Kết nối tri thức đầy đủ kiến thức, lý thuyết và bài tập được biên soạn bám sát theo nội dung sách giáo khoa Lớp 10.
Lớp 10 | Các môn học Lớp 10 | Giải bài tập, đề kiểm tra, đề thi Lớp 10 chọn lọc
Danh sách các môn học Lớp 10 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2025 ngắn gọn, chi tiết dễ hiểu.
Toán Học
- SBT Toán 10 Nâng cao
- Chuyên đề học tập Toán 10 - Cánh diều
- Chuyên đề học tập Toán 10 - Chân trời sáng tạo
- Chuyên đề học tập Toán 10 - Kết nối tri thức
- SBT Toán 10 - Chân trời sáng tạo
- SBT Toán 10 - Kết nối tri thức
- SGK Toán 10 - Cánh diều
- SGK Toán 10 - Chân trời sáng tạo
- SGK Toán 10 - Kết nối tri thức
Vật Lý
- SBT Vật lí 10 - Chân trời sáng tạo
- SBT Vật lí 10 - Kết nối tri thức
- SGK Vật Lí 10 - Cánh diều
- SGK Vật Lí 10 - Chân trời sáng tạo
- SGK Vật Lí 10 - Kết nối tri thức
Hóa Học
- SBT Hóa học 10 Nâng cao
- Chuyên đề học tập Hóa 10 - Cánh diều
- Chuyên đề học tập Hóa 10 – Chân trời sáng tạo
- Chuyên đề học tập Hóa 10 - Kết nối tri thức
- SBT Hóa 10 - Chân trời sáng tạo
- SBT Hóa 10 - Kết nối tri thức
- SGK Hóa 10 - Cánh diều
- SGK Hóa 10 - Chân trời sáng tạo
- SGK Hóa 10 - Kết nối tri thức
Ngữ Văn
- Soạn văn 10
- SBT Ngữ văn lớp 10
- SBT Văn 10 - Cánh diều
- SBT Văn 10 - Chân trời sáng tạo
- SBT Văn 10 - Kết nối tri thức
- Soạn văn 10 - Cánh Diều - chi tiết
- Soạn văn 10 - Cánh Diều - siêu ngắn
- Soạn văn 10 - Chân trời sáng tạo - chi tiết
- Soạn văn 10 - Chân trời sáng tạo - siêu ngắn
- Soạn văn 10 - Kết nối tri thức - chi tiết
- Soạn văn 10 - Kết nối tri thức - siêu ngắn
Sinh Học
- Chuyên đề học tập Sinh 10 - Chân trời sáng tạo
- Chuyên đề học tập Sinh 10 - Kết nối tri thức
- SBT Sinh lớp 10 - Cánh diều
- SBT Sinh lớp 10 - Chân trời sáng tạo
- SBT Sinh lớp 10 - Kết nối tri thức
- SGK Sinh 10 - Cánh diều
- SGK Sinh 10 - Chân trời sáng tạo
- SGK Sinh 10 - Kết nối tri thức
GDCD
- SGK Giáo dục quốc phòng và an ninh 10 - Cánh diều
- SGK Giáo dục quốc phòng và an ninh 10 - Kết nối tri thức
- SGK Giáo dục thể chất 10 - Cánh diều
- SGK Giáo dục thể chất 10 - Kết nối tri thức
- SGK Giáo dục kinh tế và pháp luật 10 - Cánh diều
- SGK Giáo dục kinh tế và pháp luật 10 - Chân trời sáng tạo
- SGK Giáo dục kinh tế và pháp luật 10 - Kết nối tri thức
Tin Học
Tiếng Anh
- SBT Tiếng Anh lớp 10
- SBT Tiếng Anh 10 - English Discovery
- SBT Tiếng Anh 10 - Bright
- SBT Tiếng Anh 10 - iLearn Smart World
- SBT Tiếng Anh 10 - Friends Global (Chân trời sáng tạo)
- SBT Tiếng Anh 10 - Global Success (Kết nối tri thức)
- Tiếng Anh 10 - Bright
- Tiếng Anh 10 - Explore New Worlds
- Tiếng Anh 10 - English Discovery
- Tiếng Anh 10 - iLearn Smart World
- Tiếng Anh 10 - Friends Global
- Tiếng Anh 10 - Global Success
Công Nghệ
Lịch Sử & Địa Lý
- Tập bản đồ Địa lí lớp 10
- SBT Địa lí 10 - Chân trời sáng tạo
- SBT Địa lí 10 - Kết nối tri thức
- SGK Địa lí lớp 10 - Cánh Diều
- SGK Địa lí lớp 10 - Kết nối tri thức
- SGK Địa lí lớp 10 - Chân trời sáng tạo
- Tập bản đồ Lịch sử lớp 10
- SGK Lịch sử 10 - Cánh Diều
- SGK Lịch sử 10 - Chân trời sáng tạo
- SGK Lịch sử 10 - Kết nối tri thức