Lý thuyết Một số bazơ quan trọng
A. NATRI HIĐROXIT (NaOH)
I. Tính chất vật lí
- Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
- Dung dịch NaOH có tính nhờn, làm bục vải giấy và ăn mòn da. Khi sử dụng NaOH phải hết sức cẩn thận.
II. Tính chất hóa học
Natri hiđroxit có đầy đủ tính chất của một bazơ tan (kiềm).
1. Làm đổi màu chất chỉ thị.
- Dung dịch NaOH làm đổi màu qùy tím thành xanh.
- Dung dịch phenolphatalein không màu thành màu đỏ.
2. Tác dụng với axit → muối + nước (phản ứng trung hòa)
Thí dụ:
NaOH + HCl → NaCl + H2O
2NaOH + H2SO4 → Na2SO4 + H2O
3. Tác dụng với oxit axit → muối + nước
Thí dụ:
2NaOH + CO2 → Na2CO3 + H2O
2NaOH + SO2 → Na2SO3 + H2O
(khi NaOH tác dụng với \(CO_2, SO_2\) còn có thể tạo ra muối axit NaHCO3, NaHSO3)
4. Tác dụng với dung dịch muối.
Thí dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
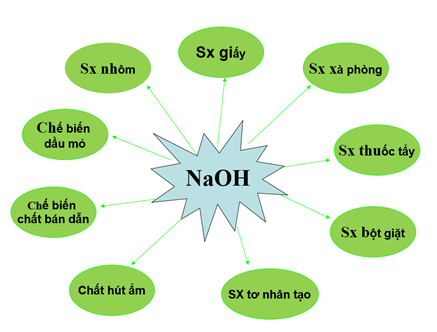
III. Ứng dụng
Natri hiđroxit có nhiều ứng dụng trong đời sống và trong sản xuất. Nó được dùng trong:
IV. Sản xuất Natri hiđroxit
- Trong công nghiệp, NaOH được điều chế bằng cách điện phân dung dịch NaCl
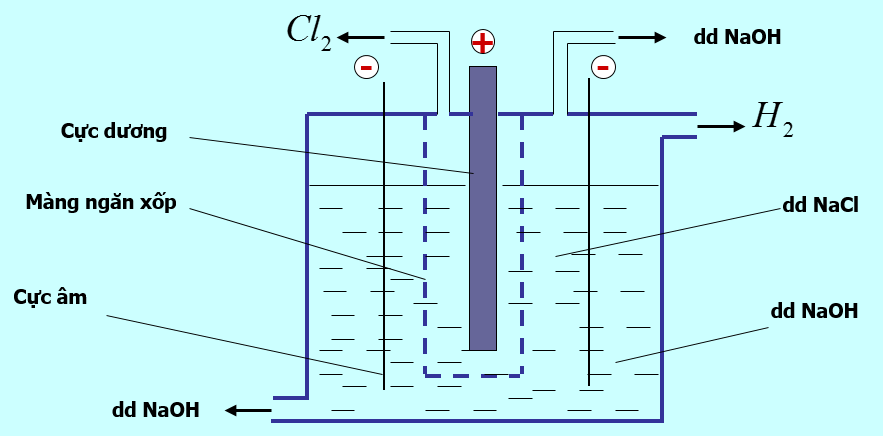
- Phương trình điện phân:
2NaCl + 2H2O $\xrightarrow[mang\,\,ngan\,\,xop]{đpdd}$ 2NaOH + H2 + Cl2
- Tác dụng của màng ngăn xốp: không cho khí clo thoát ra tác dụng với dung dịch NaOH vì xảy ra phản ứng:
Cl2 + 2NaOH → NaCl + NaClO + H2O
B. CANXI HIĐROXIT Ca(OH)2
I. Tính chất hóa học Ca(OH)2
- Ca(OH)2 có tính chất hóa học của một bazơ tan.
1. Làm đổi màu chất chỉ thị
- Làm đổi màu qùy tím thành xanh.
- Dung dịch phenolphatalein không màu thành màu đỏ.
2. Ca(OH)2 + axit → muối + nước (phản ứng trung hòa)
Phương trình hóa học :
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Ca(OH)2 + H2SO4 → CaSO4 + H2O
3. Dung dịch Ca(OH)2 + oxit axit → muối + nước
Phương trình hóa học
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + SO2 → CaSO3↓ + H2O
4. Ca(OH)2 + dung dịch muối → muối mới + bazo mới
Phương trình hóa học
Ca(OH)2 + FeCl2 → Fe(OH)2↓ + CaCl2
II. Ứng dụng
- Làm vật liệu trong xây dựng.
- Khử chua đất trồng trọt.
- Khử độc các chất thải công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật…
III. Thang PH
- pH = 7: Dung dịch là trung tính Thí dụ : nước cất có pH = 7
- pH < 7: Dung dịch có tính axit, pH càng nhỏ độ axit càng lớn.
- pH > 7: Dung dịch có tính bazơ, pH càng lớn độ bazơ càng lớn.
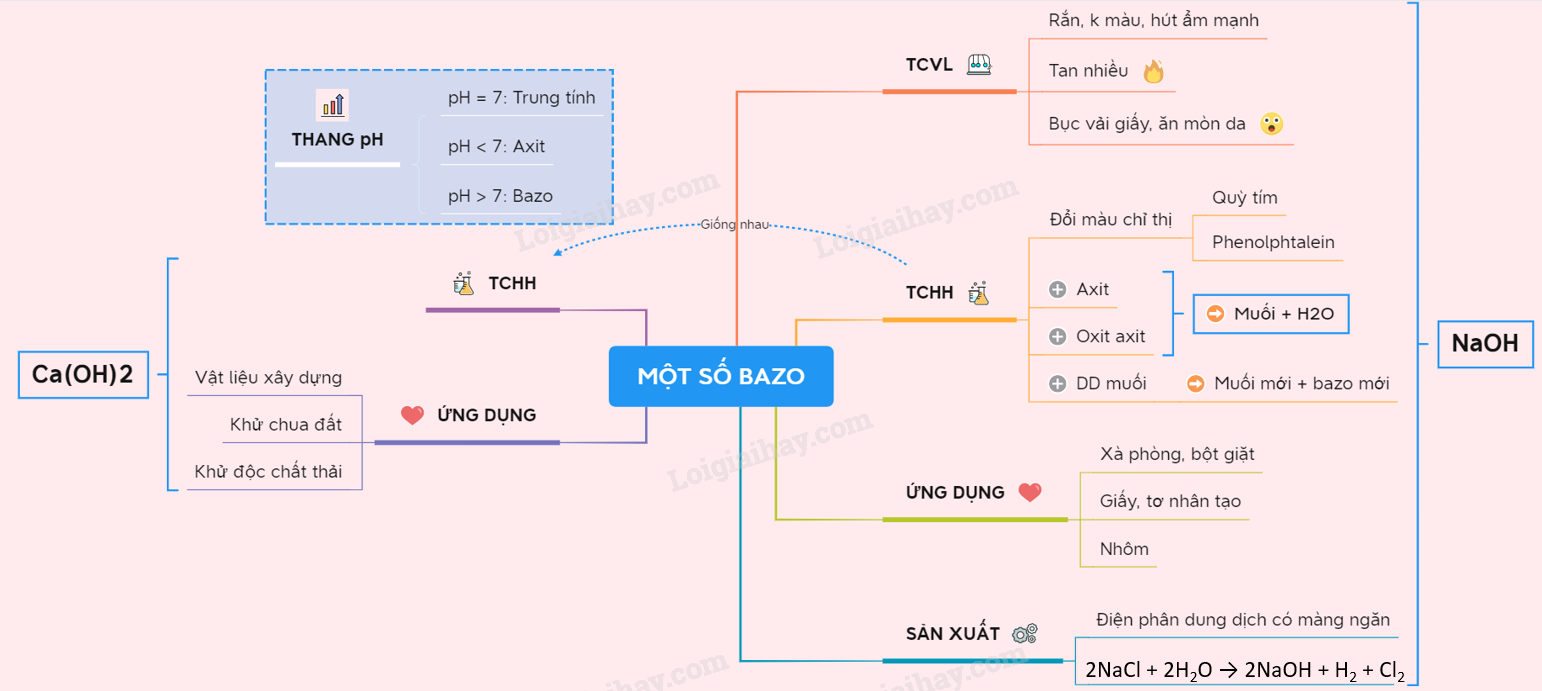
Sơ đồ tư duy: Một số bazo quan trọng
- Bài 1 trang 27 SGK Hóa học 9
- Bài 2 trang 27 SGK Hóa học 9
- Bài 3 trang 27 SGK Hóa học 9
- Bài 1 trang 30 SGK Hóa học 9
- Bài 2 trang 30 SGK Hóa học 9
- Bài 3 trang 30 SGK Hóa học 9
- Bài 4 trang 30 SGK Hóa học 9
SGK Hóa lớp 9
Giải bài tập hóa học lớp 9 đầy đủ công thức, lý thuyết, phương trình hóa học, chuyên đề hóa học SGK 9 giúp để học tốt hóa học 9
CHƯƠNG 1: CÁC LOẠI HỢP CHẤT VÔ CƠ
- Bài 1. Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
- Bài 2. Một số oxit quan trọng
- Bài 3. Tính chất hóa học của axit
- Bài 4. Một số axit quan trọng
- Bài 5. Luyện tập: Tính chất hóa học của oxit và axit
- Bài 6. Thực hành: Tính chất hóa học của oxit và axit
- Bài 7. Tính chất hóa học của bazơ
- Bài 8. Một số bazơ quan trọng
- Bài 9. Tính chất hóa học của muối
- Bài 10. Một số muối quan trọng
- Bài 11. Phân bón hóa học
- Bài 12. Mối quan hệ giữa các loại chất vô cơ
- Bài 13. Luyện tập chương 1: Các hợp chất vô cơ
- Bài 14. Thực hành: Tính chất hóa học của bazơ và muối
- Đề kiểm tra 15 phút - Chương 1 - Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) - Chương 1 - Hóa học 9
Đề thi giữa học kì - Hóa học 9
CHƯƠNG 2: KIM LOẠI
- Bài 15. Tính chất vật lí của kim loại
- Bài 16. Tính chất hoá học của kim loại
- Bài 17. Dãy hoạt động hoá học của kim loại
- Bài 18. Nhôm
- Bài 19. Sắt
- Bài 20. Hợp kim sắt: Gang, thép
- Bài 21. Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- Bài 22. Luyện tập chương 2: Kim loại
- Bài 23. Thực hành: Tính chất hóa học của nhôm và sắt
- Bài 24. Ôn tập học kì 1
- Đề kiểm tra 15 phút - Chương 2 - Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) - Chương 2 - Hóa học 9
Đề thi học kì 1 mới nhất có lời giải
CHƯƠNG 3: SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
- Bài 25. Tính chất của phi kim
- Bài 26. Clo
- Bài 27. Cacbon
- Bài 28. Các oxit của cacbon
- Bài 29. Axit cacbonic và muối cacbonat
- Bài 30. Silic. Công nghiệp silicat.
- Bài 31. Sơ lược về bảng tuần hoàn các nguyên tố hoá học
- Bài 32. Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hoá học
- Bài 33. Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng
- Đề kiểm tra 15 phút - Chương 3 – Hóa học 9
CHƯƠNG 4: HIĐROCACBON. NHIÊN LIỆU
- Bài 34. Khái niệm về hợp chất hữu cơ và hoá học hữu cơ
- Bài 35. Cấu tạo phân tử hợp chất hữu cơ
- Bài 36. Metan
- Bài 37. Etilen
- Bài 38. Axetilen
- Bài 39. Benzen
- Bài 40. Dầu mỏ và khí thiên nhiên
- Bài 41. Nhiên liệu
- Bài 42. Luyện tập chương 4: Hiđrocacbon. Nhiên liệu
- Bài 43. Thực hành: Tính chất của Hiđrocacbon
- Đề kiểm tra 15 phút - Chương 4 - Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Hóa học 9
CHƯƠNG 5: DẪN XUẤT CỦA HIĐROCACBON. POLIME
- Bài 44. Rượu etylic
- Bài 45. Axit axetic
- Bài 46. Mối liên hệ giữa etilen, rượu etylic và axit axetic
- Bài 47. Chất béo
- Bài 48. Luyện tập rượu etylic, axit axetic và chất béo
- Bài 49. Thực hành: Tính chất của rượu và axit
- Bài 50. Glucozơ
- Bài 51. Saccarozơ
- Bài 52. Tinh bột và xenlulozơ
- Bài 53. Protein
- Bài 54. Polime
- Bài 55. Thực hành: Tính chất của gluxit
- Bài 56. Ôn tập cuối năm - Hóa học 9
- Đề kiểm tra 15 phút - Chương 5 - Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) - Chương 5 - Hóa học 9
Xem Thêm
Lớp 9 | Các môn học Lớp 9 | Giải bài tập, đề kiểm tra, đề thi Lớp 9 chọn lọc
Danh sách các môn học Lớp 9 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2025 ngắn gọn, chi tiết dễ hiểu.
Toán Học
Vật Lý
Hóa Học
Ngữ Văn
- SBT Ngữ văn lớp 9
- Đề thi vào 10 môn Văn
- Tác giả - Tác phẩm văn 9
- Văn mẫu lớp 9
- Vở bài tập Ngữ văn lớp 9
- Soạn văn 9 chi tiết
- Soạn văn 9 ngắn gọn
- Soạn văn 9 siêu ngắn
Sinh Học
GDCD
Tin Học
Tiếng Anh
- SBT Tiếng Anh lớp 9
- Đề thi vào 10 môn Anh
- SGK Tiếng Anh lớp 9
- SBT Tiếng Anh lớp 9 mới
- Vở bài tập Tiếng Anh 9
- SGK Tiếng Anh lớp 9 Mới
Công Nghệ
Lịch Sử & Địa Lý
- Tập bản đồ Địa lí lớp 9
- SBT Địa lí lớp 9
- VBT Địa lí lớp 9
- SGK Địa lí lớp 9
- Tập bản đồ Lịch sử lớp 9
- SBT Lịch sử lớp 9
- VBT Lịch sử lớp 9
- SGK Lịch sử lớp 9