Đề số 16 - Đề thi thử THPT Quốc gia môn Hóa học
Đề bài
Câu 1. Phát biểu nào sau đây không đúng?
A. Trong dung dịch, H2N – CH2 – COOH còn tồn tại ở dạng ion lưỡng cực H3N+– CH2 – COO-.
B. Aminoaxit là hợp chất hữu cơ tạp chức, phân tử chứa đồng thời nhóm amino và nhóm cacboxyl.
C. Aminoaxit là những chất rắn, kết tinh, không màu, dễ tan trong nước và có vị ngọt.
D. Hợp chất H2N – CH2 – COOH3N – CH3 là este của glyxin.
Câu 2. Không nên dùng xà phong khi giặt rửa với nước cứng vì:
A. Xuất hiện kết tủa làm giảm tác dụng giặt rửa và ảnh hưởng đến chất lượng sợi vải.
B. Gây ô nhiễm môi trường.
C. Tạo ra kết tủa CaCO3, MgCO3 bám lên sợi vải.
D. Gây hại cho da tay.
Câu 3. Kim loại nào sau đây có nhiệt độ nóng chảy thấp nhất?
A. Pb B. Au
C. W D. Hg
Câu 4. Hòa tan hoàn toàn 0,575 gam một kim loại kiềm X vào nướC. Để trung hòa dung dịch thu được cần 25 gam dung dịch HCl 3,65%. Kim loại X là?
A.NA. B. Li.
C. RB. D. K
Câu 5. Hòa tan m gam hỗn hợp X gồm Na và Al vào nước dư, thu được 8,96 lít khí. Cũng hòa tan hoàn toàn m gam hỗn hợp X đó và dung dịch NaOH dư, thu được 12,32 lít khí (đktc). Giá trị của m là:
A. 21,1. B. 11,9.
C. 22,45. D. 12,7.
Câu 6. Phát biểu nào sau đây đúng?
A. Criolit có tác dụng hạ nhiệt độ nóng chảy của Al.
B. Trong ăn mòn điện hóa trên cực âm xảy ra quá trình oxi hóa.
C. Kim loại dẫn điện tốt nhất là Cu.
D. Trong điện phân dung dịch NaCl trên catot xảy ra quá trình oxi hóa nước.
Câu 7. Đun nóng m1 gam ancol no, đơn chức, mạch hở X với H2SO4 đặc ở nhiệt độ thích hợp thu được m2 gam chất hữu cơ Y. Tỉ khối hơi của Y so với X bằng 0,7. Hiệu suất của phản ứng đạt 100%. X có công thức phân tử là:
A. C2H5OH B. C3H7OH
C. C5H11OH D. C4H9OH
Câu 8. Trong công nghiệp, để sản xuất gương soi và ruột phích nước, người ta cho dung dịch AgNO3 trong NH3 tác dụng với chất nào sau đây?
A. Saccarozơ. B. Axetilen.
C. Anđehit fomic. D. Glucozơ.
Câu 9. Trong cơ thể Lipit bị oxi hóa thành:
A. NH3, CO2, H2O.
B. NH3 và H2O.
C. H2O và CO2.
D. Amoniac và cabonic.
Câu 10. Cho tất cả các đồng phân đơn chức, mạch hở, có cùng công thức phân tử C2H4O2 lần lượt tác dụng với Na, NaOH, NaHCO3. Số phản ứng xảy ra là:
A. 2. B. 4.
C. 5. D. 3.
Câu 11. Xà phòng hóa hoàn toàn 22,2 gam hỗn hợp 2 este HCOOC2H5 và CH3COOCH3 bằng dung dịch NaOH 1M đun nóng. Thể tích dung dịch NaOH tối thiểu cần dùng là:
A. 150ml. B. 300ml.
C. 200ml. D. 400ml.
Câu 12. Ngâm thanh Cu dư vào dung dịch AgNO3 thu được dung dịch X. Sau đó ngâm thanh Fe dư vào dung dịch X thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Dung dịch Y có chứa chất tan là:
A. Fe(NO3)2
B. Fe(NO3)2; Cu(NO3)2.
C. Fe(NO3)3
D. Fe(NO3)3; Fe(NO3)2.
Câu 13. Trong các phản ứng giữa các cặp chất dưới đây, phản ứng nào làm giảm mạch polime?
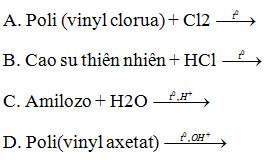
Câu 14. Kim loại nào sau đây không điều chế được bằng phương pháp thủy luyện?
A. Cu. B. Ag.
C. Al. D. Ni.
Câu 15. Cho các chất sau: C2H5OH, CH3COOH, HCOOH, C6H5OH.
Chiều tăng dần độ linh động của nguyên tử H trong các nhóm chức của 4 chất trên là:
A. C6H5OH, C2H5OH, HCOOH, CH3COOH.
B. C2H5OH, C6H5OH, CH3COOH, HCOOH.
C. C6H5OH, C2H5OH, CH3COOH, HCOOH.
D. C2H5OH, C6H5OH, HCOOH, CH3COOH.
Câu 16. Cho phương trình hóa học của phản ứng sau:
Fe + CuSO4 → FeSO4 + Cu
Phát biểu nào sau đây đúng?
A. Kim loại Cu có tính khử mạnh hơn kim loại Fe.
B. Kim loại Cu khử được ion Fe2+.
C. Ion Fe2+ có tính oxi hóa mạnh hơn ion Cu2+.
D. Ion Cu2+ có tính oxi hóa mạnh hơn ion Fe2+
Câu 17. Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,8 lít khí CO2; 2,8 lít N2 (các thể tích khí đo ở đktc) và 20,25 gam H2O. Công thức phân tử của X là:
A. C3H9N. B. C3H7N.
C. C2H7N. D. C4H9N.
Câu 18. Cho 7,2 gam bột Mg tan hết trong dung dịch hỗn hợp HCl (dư) và KNO3 thu được dung dịch X chứa m gam muối và 2,688 lít khí Y (đktc) gồm N2 và H2 có khối lượng 0,76 gam. Giá trị của m là:
A. 34,68. B. 19,87.
C. 24,03. D. 36,48.
Câu 19. Cho dung dịch metylamin đến dư vào các dung dịch sau: FeCl3; CuSO4; Zn(NO3)2; CH3COOH thì số lượng kết tủa thu được là:
A. 1. B. 0.
C. 3. D. 2.
Câu 20.Cho các cặp chất sau:
(1). Khí Br2 và khí O2.
(5). Dung dịch AgNO3 và dung dịch Fe(NO3)2
(2). Khí H2S và dung dịch FeCl3
(6). Dung dịch KMnO4 và khí SO2.
(3). Khí H2S và dung dịch Pb(NO3)2.
(7). Hg và S.
(4). CuS và dung dịch HCl.
(8). Khí Cl2 và dung dịch NaOH.
Số cặp chất xảy ra phản ứng hóa học ở nhiệt độ thường là:
A. 5. B. 7.
C. 8. D. 6.
Câu 21. Thuốc thử phân biệt glucozo với fructozo là:
A. H2. B. [Ag(NH3)2]OH
C. Dung dịch Br2. D. Cu(OH)2.
Câu 22. Cho dãy các chất sau: KHCO3; Ba(NO3)2; SO3; KHSO4; K2SO3; K2SO4; K3PO4. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là:
A. 2. B. 4.
C. 5. D. 3.
Câu 23. Có bao nhiêu andehit là đồng phân cấu tạo có cùng công thức phân tử C5H10O?
A. 6. B. 5.
C. 4. D. 3.
Câu 24. Hòa tan Fe3O4 trong lượng dư dung dịch H2SO4 loãng thu được dung dịch X. Dung dịch X tác dụng được với bao nhiêu chất trong số các chất sau: Cu, NaOH, Br2, AgNO3, KMnO4, MgSO4, Mg(NO3)2, Al, H2S?
A. 6. B. 8.
C. 5. D. 7.
Câu 25. Bột Ag có lẫn tạp chất là Fe, Cu và PB. Muốn có Ag tinh khiết, người ta ngâm hỗn hợp vào một lượng dư dung dịch X, sau đó lọc lấy Ag. Dung dịch X là:
A. AgNO3. B. HCl.
C. NaOH. D. H2SO4.
Câu 26. Hòa tan hoàn toàn 2,4 gam Mg bằng dung dịch H2SO4 loãng, thu được V lít khí H2 (đktc). Giá trị của V là:
A. 5,60. B. 2,24.
C. 4,48. D. 3,36.
Câu 27. Thực hiện các thí nghiệm sau:
(1) Nung NaHCO3 rắn.
(2). Cho CaOCl2 vào dung dịch HCl đặc
(3) Sục khí CO2 vào dung dịch Ba(OH)2 dư
(4) Sục khí SO2 vào dung dịch KMnO4
(5). Cho dung dịch KHSO4 vào dung dịch NaHCO3.
(6). Sục khí Cl2 vào dung dịch KI.
Số thí nghiệm sinh ra chất khí là:
A. 5. B. 4.
C. 2. D. 3.
Câu 28. Cho sơ đồ phản ứng sau:
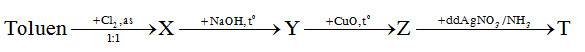
Biết X, Y, Z, T là các hợp chất hữu cơ và là những sản phẩm chính. Công thức cấu tạo đúng nhất của T là chất nào sau đây?
A. C6H5 – COOH
B. CH3– C6H4 – COONH4
C. C6H5 – COONH4
D. p – HOOC – C6H4 – COONH4
Câu 29. Thực hiện các thí nghiệm sau:
(1) Nhúng thanh Fe nguyên chất vào dung dịch CuCl2.
(2) Nhúng thanh Fe nguyên chất vào dung dịch FeCl3.
(3) Nhúng thanh Fe nguyên chất vào dung dịch HCl loãng, có lẫn CuCl2.
(4) Cho dung dịch FeCl3 vào dung dịch AgNO3.
(5) Để thanh thép lâu ngày ngoài không khí ẩm.
Số trường hợp xảy ra ăn mòn điện hóa học là:
A. 4. B. 2.
C. 1. D. 3.
Câu 30. Thực hiện phản ứng nhiệt nhôm m gam hỗn hợp X gồm Al và Fe3O4 đến khi phản ứng hoàn toàn thu được hỗn hợp Y (biết Fe3O4 chỉ bị khử về Fe). ChiaY thành hai phần:
- Phần 1: cho tác dụng với dung dịch NaOH dư thu được 0,15 mol H2, dung dịch Z và phần không tan T. Cho toàn bộ phần không tan T tác dụng với dung dịch HCl dư thu được 0,45 mol H2.
- Phần 2: Cho tác dụng với dung dịch HCl thu được 1,2 mol H2.
Giá trị của m là:
A. 173,8. B. 144,9.
C. 135,4. D. 164,6.
Câu 31. Cho hỗn hợp A gồm tetrapeptit X và pentapeptit Y (đều hở và đều tạo bởi Gly và Ala). Đun nóng m gam hỗn hợp A với dung dịch NaOH vừa đủ rồi cô cạn cẩn thận dung dịch thu được (m+ 7,9) gam muối khan. Đốt cháy hoàn toàn hỗn hợp muối, được Na2CO3 và hỗn hợp B (khí và hơi). Cho B vào bình đựng dung dịch Ba(OH)2 dư thấy khối lượng bình tăng 28,02 gam và có 2,464 lít khí bay ra (đktc). Phần trăm khối lượng của Y trong A là:
A. 46,94%. B. 64,63%.
C. 69,05%. D. 44,08%.
Câu 32. Hòa tan 13,68 gam muối MSO4 vào nước được dung dịch X. Điện phân X (với điện cực trơ, cường độ dòng điện không đổi) trong thời gian t (giây) được y gam kim loại M duy nhất ở catot và 0,035 mol khí ở anot. Còn nếu thời gian điện phân là 2t (giây) thì tổng số mol khí thu được ở cả hai điện cực là 0,1245 mol. Giá trị của y là:
A.1,680. B. 4,788.
C. 4,480. D. 3,920.
Câu 33. Cho 4,725 gam bột Al vào dung dịch HNO3 loãng, dư thu được dung dịch X chứa 37,275 gam muối và V lít khí NO duy nhất (đktc). Giá trị của V là:
A. 3,920 lít. B. 11,760 lít.
C. 3,584 lít. D. 7,168 lít.
Câu 34. Cho m gam este E phản ứng hết với 150 ml NaOH 1M. Để trung hòa dung dịch thu được dùng 60 ml HCl 0,5M. Cô cận dung dịch sau khi trung hòa được 11,475 gam hỗn hợp hai muối khan và 4,68 gam hỗn hợp hai ancol đơn chức liên tiếp. Công thức cấu tạo thu gọn của este E và giá trị m là:
A. CH2(COOCH3)(COOC2H5) và 9,6 gam.
B. C2H4(COOCH3)(COOC2H5) và 9,6 gam.
C. CH2(COOCH3)(COOC2H5) và 9,06 gam.
D. C2H4(COOCH3)(COOC2H5) và 9,06 gam.
Câu 35. Hợp chất X mạch hở có công thức phân tử là C4H9NO2. Cho 15,45 gam X phản ứng với dung dịch NaOH sinh ra một chất khí Y và dung dịch Z. Khí Y nặng hơn không khí, làm giấy quì tím ẩm chuyển màu xanh. Dung dịch Z có khả năng làm mất màu nước brom. Cô cạn dung dịch Z thu được m gam muối khan. Giá trị của m là:
A. 16,2. B. 12,3.
C. 14,1. D. 14,4.
Câu 36. Hòa tan hết 31,12 gam hỗn hợp X gồm Mg, Fe, Fe3O4, FeCO3 vào dung dịch hỗn hợp chứa H2SO4 và KNO3. Sau phản ứng thu được 4,48 lít hỗn hợp khí Y (đktc) gồm (CO2; NO; NO2; H2) có tỉ khối hơi so với H2 là 14,6 và dung dịch Z chỉ chứa các muối trung hòa với tổng khối lượng là m gam. Cho BaCl2 dư vào Z thấy xuất hiện 140,965 gam kết tủa trắng. Mặt khác, cho NaOH dư vào Z thì thấy có 1,085 mol NaOH phản ứng đồng thời xuất hiện 42,9 gam kết tủa và 0,56 lít khí (đktc) thoát rA. Biết các phản ứng xảy ra hoàn toàn. Cho các nhận định sau:
(a) Giá trị của m là 82,285 gam.
(b) Số mol của KNO3 trong dung dịch ban đầu là 0,225 mol.
(c) Phần trăm khối lượng của FeCO3 trong X là 18,638%.
(d) Số mol của Fe3O4 trong X là 0,05 mol.
(e) Số mol Mg trong X là 0,15 mol
Số nhận định đúng là:
A. 4. B. 1.
C. 3. D. 2
Câu 37. X, Y, Z là 3 este đều mạch hở và không chứa các nhóm chức khác (trong đó X, Y đều đơn chức, Z hai chức). Đun nóng 19,28 gam hỗn hợp E chứa X, Y, Z với dung dịch NaOH vừa đủ thu được hỗn hợp F chỉ chứa 2 muối có tỉ lệ mol 1:1 và hỗn hợp 2 ancol đều no, có cùng số nguyên tử cacbon. Dẫn toàn bộ hỗn hợp 2 ancol này qua bình đựng Na dư, thấy khối lượng bình tăng 8,1 gam. Đốt cháy toàn bộ F thu được CO2; 0,39 mol H2O và 0,13 mol Na2CO3. Phần trăm khối lượng của este có khối lượng phân tử nhỏ nhất trong E là:
A. 3,78%. B. 3,92%.
C. 3,96%. D. 3,84%.
Câu 38. Hỗn hợp X gồm Na, Al, Na2O và Al2O3. Hòa tan hoàn toàn 20,05 gam X vào nước thu được 2,8 lít khí H2 (đktc) và dung dịch Y. Thêm từ từ dung dịch HCl 1M vào Y đến khi bắt đầu xuất hiện kết tủa thì dùng hết 50ml, nếu thêm tiếp 310 ml nữa thì thu được m gam kết tủa. Giá trị của m là:
A. 17,94. B. 19,24.
C. 14,82. D. 31,20.
Câu 39. Trộn a gam hỗn hợp X gồm 2 hidrocacbon C6H14 và C6H6 theo tỉ lệ mol (1:1) với b gam một hidrocacbon Y rồi đốt cháy hoàn toàn thì thu được 55a/ 16,4 gam CO2 và 18,9a/ 16,4 gam H2O. Công thức phân tử của Y có dạng:
A. CnHn. B. CmH2m-2.
C. CnH2n. D. CnH2n+2.
Câu 40. Đốt cháy hoàn toàn 3,24 gam hỗn hợp X gồm hai chất hữu cơ A và B (trong đó A hơn B một nguyên tử cacbon, MA< MB), thu được m gam H2O và 9,24 gam CO2. Biết tỉ khối hơi của X so với H2 là 13,5. Giá trị của m là:
A. 1,26. B. 1,08.
C. 2,61. D. 2,16.
Lời giải chi tiết
1 | 2 | 3 | 4 | 5 |
D | A | D | A | D |
6 | 7 | 8 | 9 | 10 |
A | B | D | C | B |
11 | 12 | 13 | 14 | 15 |
B | A | C | C | B |
16 | 17 | 18 | 19 | 20 |
D | A | A | A | D |
21 | 22 | 23 | 24 | 25 |
C | C | C | A | A |
26 | 27 | 28 | 29 | 30 |
B | D | C | D | B |
31 | 32 | 33 | 34 | 35 |
A | C | A | B | C |
36 | 37 | 38 | 39 | 40 |
B | D | A | D | D |
Xem thêm: Lời giải chi tiết Đề thi thử THPT Quốc gia môn Hóa học tại Xemloigiai.com
Xemloigiai.com
- Đề số 1 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 2 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 3 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 4 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 5 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 6 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 7 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 8 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 9 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 10 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 11 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 12 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 13 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 14 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 15 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 17 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 18 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 19 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 20 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 21 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 22 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 23 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 24 - Đề thi thử THPT Quốc gia môn Hóa học
- Đề số 25 - Đề thi thử THPT Quốc gia môn Hóa học
SGK Hóa lớp 12
Giải bài tập hóa học lớp 12 đầy đủ công thức, lý thuyết, phương trình hóa học, chuyên đề hóa học SGK 12 giúp để học tốt hóa học 12, giúp luyện thi THPT Quốc gia
CHƯƠNG 1. ESTE - LIPIT
- Bài 1. Este - Hóa học 12
- Bài 2. Lipit - Hóa học 12
- Bài 3. Khái niệm về xà phòng và chất giặt rửa tổng hợp
- Bài 4. Luyện tập este và chất béo
- Đề kiểm tra 15 phút - Chương 1 – Hóa học 12
- Đề kiểm tra 45 phút - Chương 1 – Hóa học 12
CHƯƠNG 2. CACBOHIDRAT
- Bài 5. Glucozơ - Hóa học 12
- Bài 6. Saccarozơ, tinh bột và xenlulozơ
- Bài 7. Luyện tập: Cấu tạo và tính chất của Cacbohiđrat
- Bài 8. Thực hành: Điều chế, tính chất hóa học của este và cacbohiđrat
- Đề kiểm tra 15 phút - Chương 2 - Hoá học 12
- Đề kiểm tra 45 phút - Chương 2 – Hóa học 12
CHƯƠNG 3. AMIN, AMINO AXIT VÀ PROTEIN
- Bài 9. Amin
- Bài 10. Amino axit
- Bài 11. Peptit và protein
- Bài 12. Luyện tập: Cấu tạo và tính chất của amin, amino axit và protein
- Đề kiểm tra 15 phút - Chương 3 – Hóa học 12
- Đề kiểm tra 45 phút - Chương 3 – Hóa học 12
CHƯƠNG 4. POLIME VÀ VẬT LIỆU POLIME
- Bài 13. Đại cương về polime
- Bài 14. Vật liệu polime
- Bài 15. Luyện tập: Polime và vật liệu polime
- Bài 16. Thực hành: Một số tính chất của protein và vật liệu polime
- Đề kiểm tra 15 phút – Chương 4 – Hóa học 12
- Đề kiểm tra 45 phút - Chương 4 – Hóa học 12
CHƯƠNG 5. ĐẠI CƯƠNG VỀ KIM LOẠI
- Bài 17. Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
- Bài 18. Tính chất của kim loại. Dãy điện hoá của kim loại
- Bài 19. Hợp kim
- Bài 20. Sự ăn mòn kim loại
- Bài 21. Điều chế kim loại
- Bài 22. Luyện tập: Tính chất của kim loại
- Bài 23. Luyện tập: Điều chế kim loại và sự ăn mòn kim loại
- Bài 24. Thực hành: Tính chất, điều chế kim loại, sự ăn mòn kim loại
- Đề kiểm tra 15 phút - Chương 5 – Hóa học 12
- Đề kiểm tra 45 phút - Chương 5 – Hóa học 12
Đề thi học kì 1 mới nhất có lời giải
CHƯƠNG 6. KIM LOẠI KIỀM, KIM LOẠI KIỀM THỔ, NHÔM
- Bài 25. Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
- Bài 26. Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ
- Bài 27. Nhôm và hợp chất của nhôm
- Bài 28. Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
- Bài 29. Luyện tập: Tính chất của nhôm và hợp chất của nhôm
- Bài 30. Thực hành: Tính chất của natri, magie, nhôm và hợp chất của chúng
- Đề kiểm tra 15 phút - Chương 6 – Hóa học 12
- Đề kiểm tra 45 phút (1 tiết ) – Chương 6 – Hóa học 12
CHƯƠNG 7. SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG
- Bài 31. Sắt
- Bài 32. Hợp chất của sắt
- Bài 33. Hợp kim của sắt
- Bài 34. Crom và hợp chất của Crom
- Bài 35. Đồng và hợp chất của đồng
- Bài 36. Sơ lược về Niken, Kẽm, Chì, Thiếc
- Bài 37. Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
- Bài 38. Luyện tập: Tính chất hóa học của Crom, đồng và hợp chất của chúng
- Bài 39. Thực hành: Tính chất hóa học của sắt, đồng và nhưng hợp chất của sắt, crom
- Đề kiểm tra 15 phút - Chương 7 – Hóa học 12
- Đề kiểm tra 45 phút (1 tiết ) – Chương 7 – Hóa học 12
CHƯƠNG 8. PHÂN BIỆT MỘT SỐ CHẤT VÔ CƠ
- Bài 40. Nhận biết một số ion trong dung dịch
- Bài 41. Nhận biết một số chất khí
- Bài 42. Luyện tập: Nhận biết một số chất vô cơ
- Đề kiểm tra 15 phút - Chương 8 – Hóa học 12
- Đề kiểm tra 45 phút (1 tiết ) – Chương 8 – Hóa học 12
CHƯƠNG 9. HÓA HỌC VÀ VẤN ĐỀ PHÁT TRIỂN KINH TẾ, XÃ HỘI, MÔI TRƯỜNG - HÓA 12
- Bài 43. Hóa học và vấn để phát triển kinh tế
- Bài 44. Hóa học và vấn đề xã hội
- Bài 45. Hóa học và vấn đề môi trường
- Đề kiểm tra 15 phút - Chương 9 – Hóa học 12
ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 12
Xem Thêm
- ĐỀ THI THỬ THPT QUỐC GIA MÔN HÓA HỌC
- Câu hỏi tự luyện Hóa 12
- Đề thi giữa kì 1 Hóa 12
- Đề kiểm tra giữa học kì II - Hóa học 12
- Đề thi thử THPTQG các trường
- Đề thi học kì 2 Hóa 12
- Đề thi giữa kì 2 Hóa 12
- Đề thi học kì 1 Hóa 12
- Đề thi giữa học kì 1 Hóa 12
- Đề kiểm tra 1 tiết Hóa 12
- Đề kiểm tra 15 phút Hóa 12
- Đề khảo sát chất lượng đầu năm Hóa 12
Lớp 12 | Các môn học Lớp 12 | Giải bài tập, đề kiểm tra, đề thi Lớp 12 chọn lọc
Danh sách các môn học Lớp 12 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2025 ngắn gọn, chi tiết dễ hiểu.
Toán Học
Vật Lý
Hóa Học
Ngữ Văn
- Soạn văn 12
- SBT Ngữ văn lớp 12
- Văn mẫu 12
- Soạn văn 12 chi tiết
- Soạn văn ngắn gọn lớp 12
- Soạn văn 12 siêu ngắn
Sinh Học
GDCD
Tin Học
Tiếng Anh
- SBT Tiếng Anh lớp 12
- Ngữ pháp Tiếng Anh
- SGK Tiếng Anh 12
- SBT Tiếng Anh lớp 12 mới
- SGK Tiếng Anh 12 Mới
Công Nghệ
Lịch Sử & Địa Lý
- Tập bản đồ Địa lí lớp 12
- SBT Địa lí lớp 12
- SGK Địa lí lớp 12
- Tập bản đồ Lịch sử lớp 12
- SBT Lịch sử lớp 12
- SGK Lịch sử lớp 12