Đề kiểm tra 1 tiết (45 phút) - Đề số 1 - Chương II - Hóa học 11
Đề bài
I. PHẦN TRẮC NGHIỆM
Câu 1. Dãy nào sau đây được sắp xếp theo chiều tăng dần số oxi hóa của nitơ?
\(\begin{array}{l}A.NO < {N_2}O < N{H_3} < NO_3^ - < N{O_2}\\B.NH_4^ + < {N_2} < {N_2}O < NO < N{O_2}\\C.N{H_3} < {N_2} < N{O_2} < NO < {N_2}O\\D.N{H_3} < NO < {N_2}O < N{O_2} < {N_2}{O_5}\end{array}\)
Câu 2. Một bình kín dung tích 0,5 lít có chứa 0,5 mol H2 và 0,5 mol N2. Khi phản ứng đạt trạng thái cân bằng thấy có 0,02 mol NH3. Hằng số cân bằng của phản ứng tổng hợp NH3 là:
A.0,00197 B.0,00170
C.0,00500 D.0,00350
Câu 3. Trong số các phân tử sau: NCl3, NO, NF3 và NH3 phân tử phân cực mạnh nhất là:
A.NCl3 B.NO
C.NH3 D.NF3
Câu 4. Cộng hóa trị của nitơ trong các hợp chất nào sau đây lớn nhất?
A.NH4Cl B.HNO2
C.HNO3 D.NH4Cl và HNO3
Câu 5. Một nguyên tố R có cấu hình electron: 1s22s22p3, công thức hợp chất với hiđro và công thức oxit cao nhất nào sau đây là đúng?
A.RH3 và R2O3
B.RH3 và R2O5
C.RH4 và RO2
D.RH2 và RO
Câu 6. Sản phẩm của phản ứng nhiệt phân KNO3 là gì?
A.KNO2 và O2
B.K2O, NO2 và O2
C.K2O và N2
D.K, NO2 và O2
Câu 7. Chất nào sau đây có thể làm khô khí NH3?
A.H2SO4 đặc
B.CuSO4 khan
C.HCl
D.CaO
Câu 8. Cho hỗn hợp bột kim loại gồm Cu và Fe vào dung dịch HNO3 loãng, nguội dư được dung dịch (X) . Cho dung dịch NaOH vào dung dịch (X) thu được kết tủa (Y). Kết tủa (Y) gồm những chất nào sau đây?
\(\begin{array}{l}A.Fe{\left( {OH} \right)_3};Cu{\left( {OH} \right)_2}\\B.Fe{\left( {OH} \right)_2};Cu{\left( {OH} \right)_2}\\C.Fe{\left( {OH} \right)_2}\\D.Fe{\left( {OH} \right)_2};Fe{\left( {OH} \right)_3}\end{array}\)
II. PHẦN TỰ LUẬN
Câu 9. Hỗn hợp X gồm 2 khí N2 và H2 theo tỉ lệ mol là 1 : 4. Nung nóng X với xúc tác thu được hỗn hợp khí Y, trong đó NH3 chiếm 20% thể tích. Tính hiệu suất của phản ứng trên.
Câu 10. Tiến hành nung 6,06 gam muối nitrat của một kim loại kiềm thu được 5,1 gam muối nitrit. Hỏi muối nitrat đem phân hủy của kim loại là gì?
Câu 11. Nén hỗn hợp gồm 4 lít khí nitơ và 14 lít hiđro trong bình phản ứng ở nhiệt độ và xúc tác thích hợp. Sau phản ứng, thu được 16,4 lít hỗn hợp khí. Hãy tính thể tích khí amoniac thu được. Biết các thể tích được đo ở cùng nhiệt độ và áp suất.
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
Câu | 1 | 2 | 3 | 4 |
Đáp án | B | A | D | C |
Câu | 5 | 6 | 7 | 8 |
Đáp án | B | A | D | A |
Câu 1:
\(\mathop N\limits^{ - 3} {H_4}^ + < {\mathop N\limits^0 _2} < {\mathop N\limits^{ + 1} _2}O < \mathop N\limits^{ + 2} O < \mathop N\limits^{ + 4} {O_2}\)
Đáp án B
Câu 2:
Ta có phương trình hóa học:
N2 + 3H2 ↔ 2NH3
Ban đầu 0,5 0,5
Phản ứng 0,01 0,03 0,02
Sau pư 0,49 0,47 0,02
Hằng số cân bằng của phản ứng tổng hợp NH3 là:
\(\frac{{{{(0,02:0,5)}^2}}}{{(0,49:0,5).{{(0,47:0,5)}^3}}} = 0,00197\)
Đáp án A
Câu 3:
Đáp án D
Câu 4:
N trong HNO3 có số OXH là +5 nên HNO3 là chất có chứa N có số OXH lớn nhất
NH4Cl chứa N có số OXH là -3
HNO2 chứa N có số OXH là +3
Đáp án C
Câu 5:
R thuộc nhóm VA
=> Công thức oxit cao nhất là R2O5 và công thức hợp chất với hidro là RH3
Đáp án B
Câu 6:
KNO3 → KNO2 + ½ O2
Đáp án A
Câu 7:
Chất có thể làm khô NH3 là chất có khả năng hút nước, nhưng không tác dụng với NH3
Đáp án D
Câu 8
Ta có sơ đồ phản ứng:
\(\left\{ \begin{array}{l}Cu\\Fe\end{array} \right. + HN{O_3} \to \mathop {\left\{ \begin{array}{l}Cu{(N{O_3})_2}\\Fe{(N{O_3})_3}\end{array} \right.}\limits_X + NaOH \to \mathop {\left\{ \begin{array}{l}Cu{(OH)_2}\\Fe{(OH)_3}\end{array} \right.}\limits_Y \)
Đáp án A
II. PHẦN TỰ LUẬN
Câu 9.
Phản ứng:
\({N_2} + 3{H_2} \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2N{H_3}\)
Ban đầu: 1 4 mol
Phản ứng: x 3x 2x mol
Cân bằng (1- x) (4 - 3x) 2x mol
Ta có:
\(\dfrac{{2x}}{{\left( {1 - x} \right) + \left( {4 - 3x} \right) + 2x}} \times 100 = 20\)
\(\Rightarrow x = \dfrac{1}{{2,4}}\)
Hiệu suất: \(H = \dfrac{{2 \times \dfrac{1}{{2,4}}}}{2} \times 100\% = 41,67\% \)
Câu 10.
Gọi công thức muối nitrat của hai kim loại kiềm là: RNO3
Cách 1. \(\begin{array}{l}RN{O_3} \to RN{O_2} + \frac{1}{2}{O_2} \uparrow {\rm{ }}\left( 1 \right)\\\left( {R + 62} \right){\rm{ }}\left( {R + 46} \right){\rm{ }}\left( {gam} \right)\\6,06{\rm{ \;\;\;\;\;\;\;\;\;\;\;\; 5,1 }}\left( {gam} \right)\end{array}\)
Lập tỉ lệ: \(\begin{array}{l}\dfrac{{R + 62}}{{6,06}} = \dfrac{{R + 46}}{{5,1}}\\ \Leftrightarrow 5,1R + 316,2 = 6,06R + 278,76\\ \Rightarrow R = \dfrac{{37,44}}{{0,96}} = 39:Kali\left( K \right)\end{array}\)
Vậy công thức muối nitrat là KNO3.
Cách 2.
Theo đề bài, khi nung 6,06 gam muối nitrat tạo thành 5,1 gam muối nitrat, tức là giải phóng \(6,06 - 5,1 = 0,96\left( {gam} \right)\) oxi hay \(\dfrac{{0,96}}{{32}} = 0,03\left( {mol} \right){O_2}\)
Từ (1) \(\begin{array}{l} \Rightarrow {n_{RN{O_3}}} = 0,06\left( {mol} \right)\\ \Rightarrow {M_{RN{O_3}}} = \dfrac{{6,06}}{{0,06}} = 101\\ \Rightarrow R + 62 = 101 \Rightarrow R = 39\left( {Kali} \right)\end{array}\)
Vậy muối nitrat đem phân hủy là: KNO3.
Cách 3.
Theo đề bài, khối lượng oxi được giải phóng là: \(6,06 - 5,1 = 0,96\left( {gam} \right)\).
Vậy 0,96 gam O2 được giải phóng từ 2(R + 62) gam nitrat
Do đó:
\(\begin{array}{l}\dfrac{{6,06}}{{2\left( {R + 62} \right)}} = \dfrac{{0,96}}{{32}}\\ \Leftrightarrow 2R = \dfrac{{6,06 \times 32}}{{0,96}} - 124\\ \Rightarrow R = \dfrac{{202 - 124}}{2} = 39:Kali\left( K \right)\end{array}\)
Vậy muối nitrat đem dùng là: KNO3.
Cách 4.
Ta có: \({n_{RN{O_3}}} = \dfrac{{6,06}}{{R + 62}}\left( {mol} \right)\)
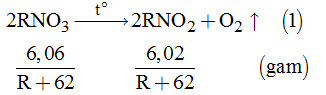
Từ (1) và đề bài \( \Rightarrow {n_{RN{O_3}}} = \dfrac{{6,06}}{{R + 62}} \times \left( {R + 46} \right) = 5,1 \)
\(\Rightarrow R = 39:Kali\left( K \right).\)
Câu 11.
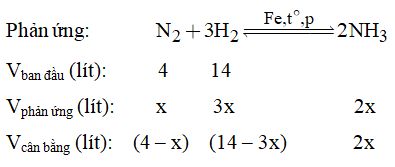
Tổng thể tích sau phản ứng:
\(18 - 2x = 16,4 \Rightarrow x = 0,8 \)
\(\Rightarrow {V_{N{H_3}}} = 1,6\left( l \right)\).
Xemloigiai.com
- Đề kiểm tra 1 tiết (45 phút) - Đề số 2 - Chương II - Hóa học 11
- Đề kiểm tra 1 tiết (45 phút) - Đề số 3 - Chương II - Hóa học 11
- Đề kiểm tra 1 tiết (45 phút) - Đề số 4 - Chương II - Hóa học 11
- Đề kiểm tra 1 tiết (45 phút) - Đề số 5 - Chương II - Hóa học 11
SGK Hóa lớp 11
Giải bài tập hóa học lớp 11 đầy đủ công thức, lý thuyết, phương trình hóa học, chuyên đề hóa học SGK 11 giúp để học tốt hóa học 11, luyện thi THPT Quốc gia
CHƯƠNG 1: SỰ ĐIỆN LI
- Bài 1. Sự điện li
- Bài 2. Axit, bazơ và muối
- Bài 3. Sự điện li của nước. pH. Chất chỉ thị Axit - bazơ
- Bài 4. Phản ứng trao đổi ion trong dung dịch các chất điện li
- Bài 5. Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
- Bài 6. Bài thực hành 1: Tính axit-bazơ. Phản ứng trao đổi ion trong dung dịch các chất điện li
- Đề kiểm tra 15 phút - Chương I - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương I - Hóa học 11
Đề kiểm tra giữa kì - Hóa học 11
CHƯƠNG 2: NITƠ - PHOTPHO
- Bài 7. Nitơ
- Bài 8. Amoniac và muối amoni
- Bài 9. Axit nitric và muối nitrat
- Bài 10. Photpho
- Bài 11. Axit photphoric và muối photphat
- Bài 12. Phân bón hóa học
- Bài 13. Luyện tập: Tính chất của Nitơ, photpho và các hợp chất của chúng
- Bài 14. Bài thực hành 2: Tính chất của một số hợp chất nitơ, photpho
- Đề kiểm tra 15 phút - Chương II - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương II - Hóa học 11
CHƯƠNG 3: CACBON - SILIC
- Bài 15. Cacbon
- Bài 16. Hợp chất của cacbon
- Bài 17. Silic và hợp chất của silic
- Bài 18. Công nghiệp silicat
- Bài 19. Luyện tập: Tính chất của cacbon, silic và các hợp chất của chúng
- Đề kiểm tra 15 phút - Chương III - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương III - Hóa học 11
CHƯƠNG 4: ĐẠI CƯƠNG VỀ HÓA HỌC HỮU CƠ
- Bài 20. Mở đầu về hoá học hữu cơ
- Bài 21. Công thức phân tử hợp chất hữu cơ
- Bài 22. Cấu trúc phân tử hợp chất hữu cơ
- Bài 23. Phản ứng hữu cơ
- Bài 24. Luyện tập: Hợp chất hữu cơ, công thức phân tử và công thức cấu tạo
- Đề kiểm tra 15 phút - Chương IV - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương IV - Hóa học 11
ĐỀ THI HỌC KÌ 1 MỚI NHẤT CÓ LỜI GIẢI
CHƯƠNG 5: HIDROCACBON NO
- Bài 25. Ankan
- Bài 26. Xicloankan
- Bài 27. Luyện tập ankan và xicloankan
- Bài 28. Bài thực hành số 3 : Phân tích định tính nguyên tố. Điều chế và tính chất của metan
- Đề kiểm tra 15 phút - Chương V - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương V - Hóa học 11
CHƯƠNG 6: HIDROCACBON KHÔNG NO
- Bài 29. Anken
- Bài 30. Ankađien
- Bài 31. Luyện tập: Anken và Ankadien
- Bài 32. Ankin
- Bài 33. Luyện tập: Ankin
- Bài 34. Bài thực hành 4 : Điều chế và tính chất của etilen và axetilen
- Đề kiểm tra 15 phút - Chương VI - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương VI - Hóa học 11
CHƯƠNG 7: HIĐROCACBON THƠM, NGUỒN HIĐROCACBON THIÊN NHIÊN. HỆ THỐNG HÓA VỀ HIĐROCACBON
- Bài 35. Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
- Bài 36. Luyện tập: Hiđrocacbon thơm
- Bài 37. Nguồn Hiđrocacbon thiên nhiên
- Bài 38. Hệ thống hóa về hiđrocacbon
- Đề kiểm tra 15 phút - Chương VII - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương VII - Hóa học 11
CHƯƠNG 8: DẪN XUẤT HALOGEN - ANCOL - PHENOL
- Bài 39. Dẫn xuất halogen của hiđrocacbon
- Bài 40. Ancol
- Bài 41. Phenol
- Bài 42. Luyện tập: Dẫn xuất halogen, ancol và phenol
- Bài 43. Bài thực hành 5: Tính chất của etanol, glixerol và phenol
- Đề kiểm tra 15 phút - Chương VIII - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương VIII - Hóa học 11
CHƯƠNG 9: ANĐEHIT - XETON - AXIT CACBOXYLIC
- Bài 44. Anđehit - xeton
- Bài 45. Axit cacboxylic
- Bài 46. Luyện tập: Anđehit - xeton - axit cacboxylic
- Bài 47. Bài thực hành 6: Tính chất của anđehit và axit cacboxylic
- Đề kiểm tra 15 phút - Chương IX - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương IX - Hóa học 11
Xem Thêm
Lớp 11 | Các môn học Lớp 11 | Giải bài tập, đề kiểm tra, đề thi Lớp 11 chọn lọc
Danh sách các môn học Lớp 11 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2025 ngắn gọn, chi tiết dễ hiểu.
Toán Học
Vật Lý
Hóa Học
Ngữ Văn
- Soạn văn 11
- SBT Ngữ văn lớp 11
- Văn mẫu 11
- Soạn văn 11 chi tiết
- Soạn văn ngắn gọn lớp 11
- Soạn văn 11 siêu ngắn
Sinh Học
GDCD
Tin Học
Tiếng Anh
Công Nghệ
Lịch Sử & Địa Lý
- Tập bản đồ Địa lí lớp 11
- SBT Địa lí lớp 11
- SGK Địa lí lớp 11
- Tập bản đồ Lịch sử lớp 11
- SBT Lịch sử lớp 11
- SGK Lịch sử lớp 11