Lý thuyết nồng độ dung dịch.
I. Nồng độ phần trăm: (C%)
* Nồng độ phần trăm (kí hiệu C%) của dung dịch cho biết số gam chất tan có trong 100 gam dung dịch.
Công thức: $C\%=\frac{{{m}_{ct}}}{{{m}_{dd}}}.100\%$
Trong đó : C% : nồng độ phần trăm của dung dịch (%)
mct : khối lượng chất tan (gam)
mdd : khối lượng dung dịch (gam) = mdung môi + mchất tan
Từ công thức tính nồng độ phần trăm, ta suy ra các công thức sau:
- Công thức tính khối lượng dung dịch: ${{m}_{dd}}=\frac{{{m}_{ct}}.100\%}{C\%}$
- Công thức tính khối lượng chất tan: ${{m}_{ct}}=\frac{{{m}_{dd}}.C\%}{100\%}$
Ví dụ 1: Hoà tan 10 gam đường vào 40 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
Giải:
Khối lượng chất tan là: mct = 10 gam
Khối lượng dung dịch thu được là: mdd = mdm + mct = 40 + 10 = 50 gam
Áp dụng công thức: $C\%=\frac{{{m}_{ct}}}{{{m}_{dd}}}.100\%=\frac{10}{50}.100\%=20\%$
II. Nồng độ mol của dung dịch (CM)
* Nồng độ mol (kí hiệu CM) của dung dịch cho biết số mol chất tan có trong một lít dung dịch.
Công thức tính: ${{C}_{M}}=\frac{n}{{{V}_{dd}}}$
Trong đó: CM là nồng độ mol (mol/lit)
n là số mol chất tan (mol)
Vdd là thể tích dung dịch (lit)
- Các công thức được suy ra từ công thức tính nồng độ mol của dung dịch:
+ Công thức tính số mol chất tan: n = CM . V
+ Công thức tính thể tích dung dịch: ${{V}_{dd}}=\frac{n}{{{C}_{M}}}$
Ví dụ: Tính khối lượng H2SO4 có trong 50 ml dung dịch H2SO4 2M
Giải:
Số mol H2SO4 có trong dung dịch H2SO4 2M là: ${{n}_{{{H}_{2}}S{{O}_{4}}}}$ = CM . V = 2 . 0,05 = 0,1 mol
=> Khối lượng H2SO4 là: ${{m}_{{{H}_{2}}S{{O}_{4}}}}$ = n . M = 0,1.98 = 9,8 gam
* Công thức chuyển đổi giữa nồng độ phần trăm và nồng độ mol:
Công thức tính nồng độ phần trăm: $C\%=\frac{{{m}_{ct}}}{{{m}_{dd}}}.100\%$ (1)
Khối lượng dung dịch được tính theo công thức: mdd = Ddd . V
với Ddd là khối lượng riêng của dung dịch (gam/lít) ; V là thể tích của dung dịch (lít)
Khối lượng chất tan là: mct = n . M
Thay vào (1) ta có: $C\%=\frac{n.M}{{{D}_{dd}}.V}.100\%=\frac{n}{V}.\frac{M}{{{D}_{dd}}}.100\%$
Mà ${{C}_{M}}=\frac{n}{V}$ => $C\%=\frac{{{C}_{M}}.M}{{{D}_{dd}}}.100\%$
=> Công thức chuyển từ nồng độ phần trăm sang nồng độ mol: ${{C}_{M}}=\frac{C\%.{{D}_{dd}}}{M.100\%}$
Lưu ý: Công thức tính này lấy đơn vị của Ddd là gam/lít, thường các đầu bài cho đơn vị của Ddd là gam/ml nên ta cần đổi lại đơn vị để áp dụng công thức.
Sơ đồ tư duy: Nồng độ dung dịch
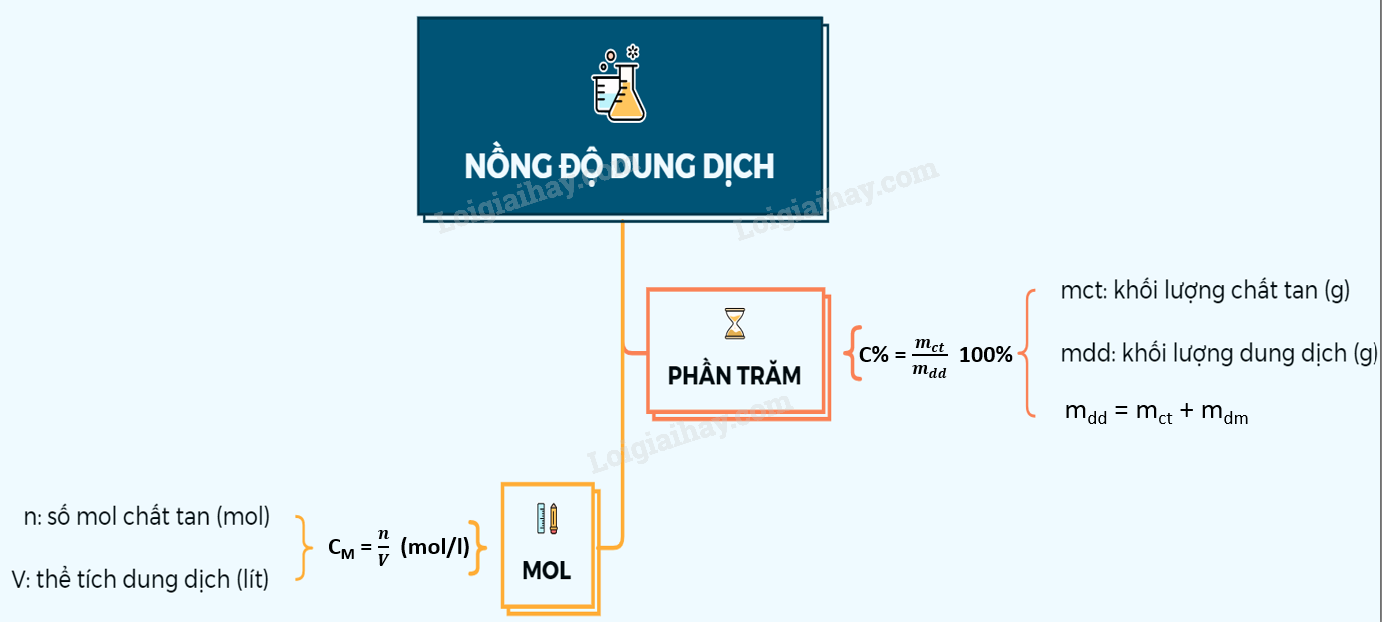
- Bài 1 trang 145 SGK Hóa học 8
- Bài 2 trang 145 SGK Hóa học 8
- Bài 3 trang 146 SGK Hóa học 8
- Bài 4 trang 146 SGK Hóa học 8
- Bài 5 trang 146 SGK Hóa học 8
- Bài 6 trang 146 SGK Hóa học 8
- Bài 7 trang 146 SGK Hóa học 8
SGK Hóa lớp 8
Giải bài tập hóa học lớp 8 đầy đủ công thức, lý thuyết, phương trình hóa học, chuyên đề hóa học SGK 8 giúp để học tốt hóa học 8
MỞ ĐẦU
CHƯƠNG 1: CHẤT - NGUYÊN TỬ - PHÂN TỬ
- Bài 2. Chất
- Bài 3. Bài thực hành 1
- Bài 4. Nguyên tử
- Bài 5. Nguyên tố hóa học
- Bài 6. Đơn chất và hợp chất - Phân tử
- Bài 7. Bài thực hành 2
- Bài 8. Bài luyện tập 1
- Bài 9. Công thức hóa học
- Bài 10. Hóa trị
- Bài 11. Bài luyện tập 2
- Đề kiểm tra 15 phút - Chương 1 - Hóa học 8
- Đề kiểm tra 45 phút (1 tiết) - Chương 1 - Hóa học 8
Đề kiểm tra giữa học kì - Hóa học 8
CHƯƠNG 2: PHẢN ỨNG HÓA HỌC
- Bài 12. Sự biến đổi chất
- Bài 13. Phản ứng hóa học
- Bài 14. Bài thực hành 3
- Bài 15. Định luật bảo toàn khối lượng
- Bài 16. Phương trình hóa học
- Bài 17. Bài luyện tập 3
- Đề kiểm tra 15 phút - Chương 2 - Hóa học 8
- Đề kiểm tra 45 phút (1 tiết) - Chương 2 - Hóa học 8
CHƯƠNG 3: MOL VÀ TÍNH TOÁN HÓA HỌC
- Bài 18. Mol
- Bài 19. Chuyển đổi giữa khối lượng thể tích và lượng chất
- Bài 20. Tỉ khối của chất khí
- Bài 21. Tính theo công thức hóa học
- Bài 22. Tính theo phương trình hóa học
- Bài 23. Bài luyện tập 4
- Đề kiểm tra 15 phút - Chương 3 - Hóa học 8
- Đề kiểm tra 45 phút (1 tiết) - Chương 3 - Hóa học 8
Đề thi học kì 1 mới nhất có lời giải
CHƯƠNG 4: OXI - KHÔNG KHÍ
- Bài 24. Tính chất của oxi
- Bài 25. Sự oxi hóa – Phản ứng hóa hợp - Ứng dụng của oxi
- Bài 26. Oxit
- Bài 27. Điều chế khí oxi - Phản ứng phân hủy
- Bài 28. Không khí - Sự cháy
- Bài 29. Bài luyện tập 5
- Bài 30. Bài thực hành 4
- Đề kiểm tra 15 phút - Chương 4 - Hóa học 8
- Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Hóa học 8
CHƯƠNG 5: HIĐRO - NƯỚC
- Bài 31. Tính chất - Ứng dụng của hiđro
- Bài 32. Phản ứng oxi hóa - khử
- Bài 33. Điều chế khí hiđro - Phản ứng thế
- Bài 34. Bài luyện tập 6
- Bài 35. Bài thực hành 5
- Bài 36. Nước
- Bài 37. Axit - Bazơ - Muối
- Bài 38. Bài luyện tập 7
- Bài 39. Bài thực hành 6
- Đề kiểm tra 15 phút - Chương 5 - Hóa học 8
- Đề kiểm tra 45 phút (1 tiết) - Chương 5 - Hóa học 8
CHƯƠNG 6: DUNG DỊCH
- Bài 40. Dung dịch
- Bài 41. Độ tan của một chất trong nước
- Bài 42. Nồng độ dung dịch
- Bài 43. Pha chế dung dịch
- Bài 44. Bài luyện tập 8
- Bài 45. Bài thực hành 7
- Đề kiểm tra 15 phút - Chương 6 - Hóa học 8
- Đề kiểm tra 45 phút (1 tiết) - Chương 6 - Hóa học 8
ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 8
Xem Thêm
Lớp 8 | Các môn học Lớp 8 | Giải bài tập, đề kiểm tra, đề thi Lớp 8 chọn lọc
Danh sách các môn học Lớp 8 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2025 ngắn gọn, chi tiết dễ hiểu.
Toán Học
Vật Lý
Hóa Học
Ngữ Văn
- SBT Ngữ văn lớp 8
- Tác giả - Tác phẩm văn 8
- Văn mẫu lớp 8
- Vở bài tập Ngữ văn lớp 8
- Soạn văn 8 chi tiết
- Soạn văn 8 ngắn gọn
- Soạn văn 8 siêu ngắn
Sinh Học
GDCD
Tin Học
Tiếng Anh
Công Nghệ
Lịch Sử & Địa Lý
- SBT Lịch sử lớp 8
- Tập bản đồ Địa lí lớp 8
- SBT Địa lí lớp 8
- VBT Địa lí lớp 8
- SGK Địa lí lớp 8
- Tập bản đồ Lịch sử lớp 8
- SBT Lịch sử lớp 8
- VBT Lịch sử lớp 8
- SGK Lịch sử lớp 8