Bài 46.12* trang 75 SBT hóa học 11
Đề bài
Hỗn hợp M chứa ba hợp chất hữu cơ X, Y và Z. Hai chất X và Y kế tiếp nhau trong một dãy đồng đẳng ( \({M_Y} > {M_X}\) ). Chất Z là đồng phân của chất Y.
Nếu làm bay hơi 3,2 g M thì thể tích hơi thu được đúng bằng thể tích của 1,68g khí nitơ ở cùng điều kiện.
Để đốt cháy hoàn toàn 16g M cần dùng vừa hết 23,52 lít \({O_2}\) (đktc). Sản phẩm cháy chỉ có \(C{O_2}\) và \({H_2}O\) với số mol bằng nhau.
Nếu cho 48g M tác dụng với Na(lấy dư), thu được 1,68 lít \({H_2}\)(đktc).
Hãy xác địng công thức phân tử, công thức cấu tạo, tên và phần trăm về khối lượng của từng chất trong hỗn hợp M.
Phương pháp giải - Xem chi tiết
+) Đặt công thức chất X là CxHyOz thì chất Y là Cx+1Hy+2Oz. Chất Z là đồng phân của Y nên CTPT giống chất Y.
+) Giả sử trong 16 g hỗn hợp M có a mol chất X và b mol hai chất Y và Z
+) Viết PTHH:
\({C_x}{H_y}{O_z} + (x + \frac{y}{4} - \dfrac{z}{2}){O_2} \to xC{O_2} + \frac{y}{2}{H_2}O\)
\({C_{x + 1}}{H_{y + 2}}{O_z} + (x + \dfrac{y}{4} - \dfrac{z}{2} + 1,5){O_2}\)\( \to (x + 1)C{O_2} + \dfrac{{y + 2}}{2}{H_2}O\)
+) Dựa vào dữ kiện đề bài và PTHH, lập hpt ẩn x, y, z, a, b.
+) Biện luận và giải hpt => CTPT của X, Y, Z.
+) Tính phần trăm về khối lượng của từng chất trong hỗn hợp M.
Lời giải chi tiết
Số mol 3 chất trong 3,20 g hỗn hợp M : \(\dfrac{{1,68}}{{28}}\) = 0,06 (mol).
Số mol 3 chất trong 16 g M : \(\dfrac{{0,06.16}}{{3,2}}\) = 0,3 (mol)
Khi đốt hỗn hợp M ta chỉ thu được CO2 và H2O.
Vậy, các chất trong hỗn hợp đó chỉ có thể chứa C, H và O.
Đặt công thức chất X là CxHyOz thì chất Y là Cx+1Hy+2Oz. Chất Z là đồng phân của Y nên công thức phân tử giống chất Y.
Giả sử trong 16 g hỗn hợp M có a mol chất X và b mol hai chất Y và Z :
\(\left\{ \begin{array}{l}
a + b = 0,3(1)\\
(12{\rm{x}} + y + 16{\rm{z}})a + (12{\rm{x}} + y + 16{\rm{z}} + 14)b = 16(2)
\end{array} \right.\)
Khi đốt 16 g M thì tổng khối lượng CO2 và H2O thu được bằng tổng khối lượng của M và O2 và bằng :
\(16 + \dfrac{{23,52}}{{22,4}}.32 = 49,6(g)\)
Mặt khác, số mol CO2 = số mol H2O = n :
44n + 18n = 49,6 \( \Rightarrow \) n = 0,8
\({C_x}{H_y}{O_z} + (x + \dfrac{y}{4} - \dfrac{z}{2}){O_2} \to xC{O_2} + \dfrac{y}{2}{H_2}O\)
a mol xa mol \(\dfrac{y}{2}\)a mol
\({C_{x + 1}}{H_{y + 2}}{O_z} + (x + \dfrac{y}{4} - \dfrac{z}{2} + 1,5){O_2}\)\( \to (x + 1)C{O_2} + \dfrac{{y + 2}}{2}{H_2}O\)
b mol (x + 1)b mol \(\dfrac{{y + 2}}{2}\)b mol
Số mol CO2 là : xa + (x + 1)b = 0,8 (mol) (3)
Số mol H2O là : \(\dfrac{{y{\rm{a}} + (y + 2)b}}{2}\) = 0,8 (mol)
do đó : ya + (y + 2)b = 1,6 (4)
Giải hệ phương trình :
Biến đổi (3) ta có x(a + b) + b = 0,8
Vì a + b = 0,3 nên b = 0,8 - 0,3x
Vì 0 < b < 0,3 nên 0 < 0,8 - 0,3x < 0,3 \( \Rightarrow \) 1,66 < x < 2,66
x nguyên \( \Rightarrow \) x = 2 \( \Rightarrow \) b = 0,8 - 0,3.2 = 0,2
\( \Rightarrow \) a = 0,3 - 0,2 = 0,1
Thay giá trị của a và b vào (4), tìm được y = 4.
Thay giá trị của a, b, x và y vào (2), tìm được z = 1.
Vậy chất X có CTPT là C2H4O, hai chất Y và Z có cùng CTPT là C3H6O.
Chất X chỉ có thể có CTCT là 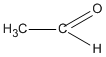 (etanal) vì chất CH2 = CH - OH không bền và chuyển ngay thành etanal.
(etanal) vì chất CH2 = CH - OH không bền và chuyển ngay thành etanal.
Chất Y là đồng đẳng của X nên CTCT là ![]() (propanal).
(propanal).
Hỗn hợp M có phản ứng với Na. Vậy, chất Z phải là ancol CH2 = CH - CH2 - OH (propenol) :
2CH2 = CH - CH2 - OH + 2Na \( \to \) 2CH2 = CH - CH2 - ONa + H2\( \uparrow \)
Số mol Z trong 48 g M là : 2.số mol H2 = 2.\(\dfrac{{1,68}}{{22,4}}\) =0,15 (mol).
Số mol Z trong 16 g M là : \(\dfrac{{0,15.16}}{{48}}\) = 0,05 (mol)
Số mol Y trong 16 g M là : 0,2 - 0,05 = 0,15 (mol).
Thành phần khối lượng của hỗn hợp M :
Chất X chiếm : \(\dfrac{{0,1.44}}{{16}}\). 100% = 27,5%.
Chất Y chiếm : \(\dfrac{{0,15.58}}{{16}}\). 100% = 54,4%.
Chất Z chiếm : \(\dfrac{{0,05.58}}{{16}}\). 100% = 18,1%.
Xemloigiai.com
- Bài 46.1, 46.2 trang 73 SBT hóa học 11
- Bài 46.3, 46.4 trang 74 SBT hóa học 11
- Bài 46.5, 46.6 trang 74 SBT hóa học 11
- Bài 46.7 trang 74 SBT hóa học 11
- Bài 46.8 trang 75 SBT hóa học 11
- Bài 46.9 trang 75 SBT hóa học 11
- Bài 46.10 trang 75 SBT hóa học 11
- Bài 46.11 trang 75 SBT hóa học 11
- Bài 46.13 trang 76 SBT hóa học 11
- Bài 46.14 trang 76 SBT hóa học 11
- Bài 46.15 trang 76 SBT hóa học 11
- Bài 46.16 trang 76 SBT hóa học 11
SBT Hóa lớp 11
Giải sách bài tập hóa học 11 , giải tất cả câu hỏi từ bài tập, lý thuyết, công thức các chương, bài chi tiết với cách giải nhanh và ngắn gọn nhất
Chương 1: Sự điện ly
- Bài 1: Sự điện ly
- Bài 2: Axit, bazơ và muối
- Bài 3: Sự điện ly của nước. pH. Chất chỉ thị axit - bazơ
- Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện ly
- Bài 5: Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện ly
Chương 2: Nitơ - Photpho
- Bài 7: Nitơ
- Bài 8: Amoniac và muối amoni
- Bài 9: Axit nitric và muối nitrat
- Bài 10: Photpho
- Bài 11: Axit photphoric và muối photphat
- Bài 12: Phân bón hóa học
- Bài 13: Luyện tập: Tính chất của nitơ, photpho và các hợp chất của chúng
Chương 3: Cacbon-Silic
- Bài 15: Cacbon
- Bài 16: Hợp chất của cacbon
- Bài 17: Silic và hợp chất của silic
- Bài 18: Công ngiệp Silicat
- Bài 19: Luyện tập: Tính chất của cacbon, silic và các hợp chất của chúng
Chương 4: Đại Cương Về Hóa Học Hữu Cơ
- Bài 20: Mở Đầu Về Hóa Học Hữu Cơ
- Bài 21: Công thức phân tử hợp chất hữu cơ
- Bài 22: Cấu trúc phân tử hợp chất hữu cơ
- Bài 23: Phản ứng hữu cơ
- Bài 24: Luyện tập: Hợp chất hữu cơ, Công thức phân tử và Công thức cấu tạo
Chương 5: Hidrocacbon No
Chương 6: Hidrocacbon không no
- Bài 29: Anken
- Bài 30: Ankadien
- Bài 31: Luyện tập: Anken và Ankadien
- Bài 32: Ankin
- Bài 33: Luyện tập: Ankin
Chương 7: Hiđrocacbon thơm. Nguồn hiđrocacbon thiên nhiên. Hệ thống hóa về hiđrocacbon
- Bài 35: Benzen và đồng đẳng. Một số hidrocacbon thơm khác
- Bài 36: Luyện tập: Hidrocacbon thơm
- Bài 37: Nguồn hidrocacbon thiên nhiên
- Bài 38: Hệ thống hóa về hiđrocacbon
Chương 8: Dẫn xuất halogen - ancol - phenol
- Bài 39: Dẫn xuất halogen của hiđrocacbon
- Bài 40: Ancol
- Bài 41: Phenol
- Bài 42: Luyện tập: Dẫn xuất Halogen, Ancol, Phenol
Chương 9: Anđehit - Xeton - Axit Cacboxylic
Lớp 11 | Các môn học Lớp 11 | Giải bài tập, đề kiểm tra, đề thi Lớp 11 chọn lọc
Danh sách các môn học Lớp 11 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2025 ngắn gọn, chi tiết dễ hiểu.
Toán Học
Vật Lý
Hóa Học
Ngữ Văn
- Soạn văn 11
- SBT Ngữ văn lớp 11
- Văn mẫu 11
- Soạn văn 11 chi tiết
- Soạn văn ngắn gọn lớp 11
- Soạn văn 11 siêu ngắn
Sinh Học
GDCD
Tin Học
Tiếng Anh
Công Nghệ
Lịch Sử & Địa Lý
- Tập bản đồ Địa lí lớp 11
- SBT Địa lí lớp 11
- SGK Địa lí lớp 11
- Tập bản đồ Lịch sử lớp 11
- SBT Lịch sử lớp 11
- SGK Lịch sử lớp 11