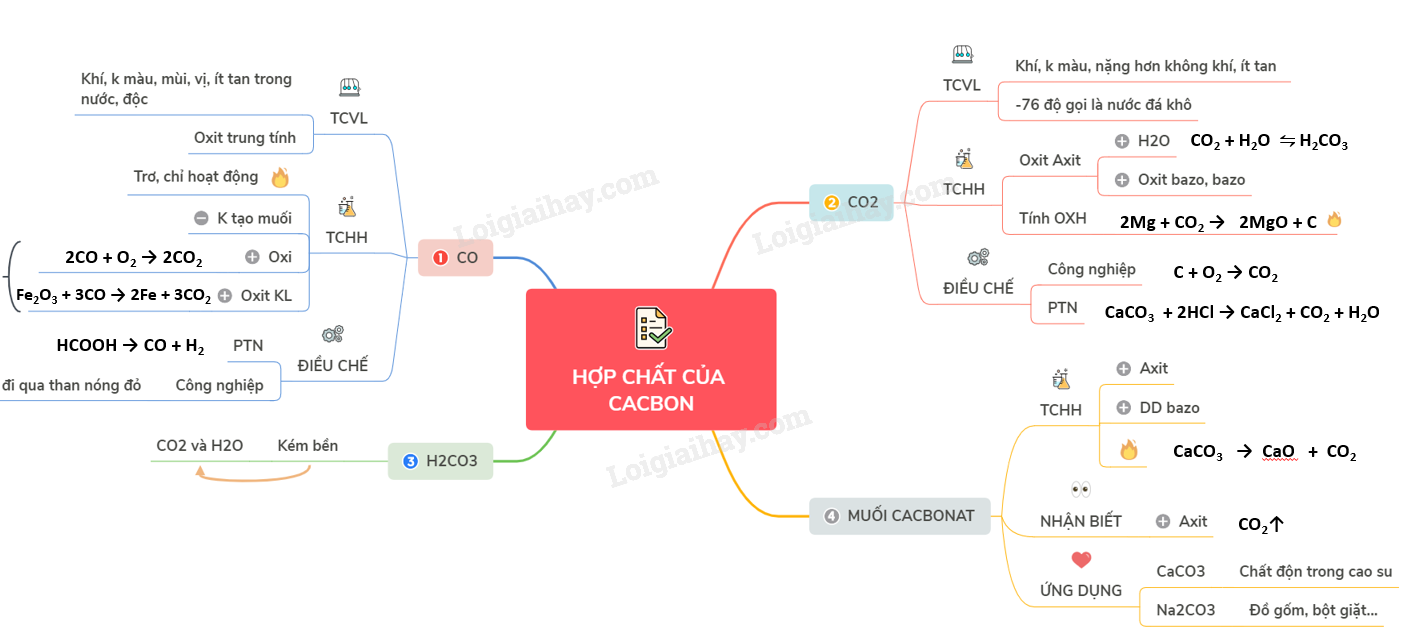
Lý thuyết hợp chất của cacbon
A. CACBON MONOXIT
I. TÍNH CHẤT VẬT LÍ
- CO là chất khí không màu, không mùi, không vị, ít tan trong nước, bền với nhiệt và rất độc.
- Kém hoạt động ở nhiệt độ thường, hoạt động nhiều hơn khi đun nóng
- CO là oxit trung tính
II. TÍNH CHẤT HÓA HỌC
- Phân tử CO có liên kết ba bền vững nên ở nhiệt độ thường C rất trơ, chỉ hoạt động trong điều kiện nhiệt độ cao.
- CO là oxit trung tính không có khả năng tạo muối → không tác dụng với dung dịch bazơ và dung dịch axit ở nhiệt độ thường.
1. Tính khử mạnh
- Tác dụng với oxi: cho ngọn lửa màu lam nhạt
2CO + O2 \(\xrightarrow{{{t}^{o}}}\) 2CO2
- Tác dụng với oxit kim loại:
Fe2O3 + 3CO \(\xrightarrow{{{t}^{o}}}\) 2Fe + 3CO2
2. Cacbon monoxit là oxit không tạo muối
III. ĐIỀU CHẾ
1. Trong phòng TN
HCOOH \(\xrightarrow{{{H_2}S{O_4}d,{t^{^o}}}}\) CO + H2
2. Trong công nghiệp
Cho hơi nước đi qua than nóng đỏ thu được khí than ướt
B. CACBON ĐIOXIT
I. TÍNH CHẤT VẬT LÍ
- CO2 là chất khí, không màu nặng hơn không khí, ít tan trong nước.
- Làm lạnh đột ngột ở -76oC, khí CO2 hóa thành khối rắn gọi là “nước đá khô”.
- Nước đá khô không nóng chảy mà thăng hoa.
II. TÍNH CHẤT HÓA HỌC
1. Tính chất của oxit axit
- Tác dụng với nước tạo thành dung dịch axit yếu.
CO2 (k) + H2O (l) ⇋ H2CO3 (dd)
- Tác dụng với oxit bazơ, bazơ tạo thành muối.
CO2 + NaOH → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
CaO + CO2 → CaCO3 (tº)
2. Tính OXH (Khi tác dụng với chất có tính khử mạnh)
2Mg + CO2 \(\xrightarrow{{{t}^{o}}}\) 2MgO + C
III. ĐIỀU CHẾ
1. Trong công nghiệp
C + O2 → CO2 (đốt cháy hoàn toàn than cốc trong không khí)
CaCO3 → CaO + CO2 (1000ºC)
2. Trong phòng thí nghiệm
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
C. AXIT CACBONIC VÀ MUỐI CACBONAT
I. AXIT CACBONIC
- Là axit kém bền, chỉ tồn tại trong dung dịch loãng, dễ bị phân hủy thành CO2 và H2O.
- Là axit hai nấc, trong dung dịch phân li hai nấc.
H2CO3 ⇋ H+ + HCO3-
HCO3- ⇋ H+ + CO32-
II. MUỐI CACBONAT
- Muối cacbonat của kim loại kiềm, amoni và đa số các muối hidrocacbonat đều tan tốt trong nước
- Muối cacbonat của các kim loại còn lại không tan, muối hidrocacbonat kếm bền nên dễ bị nhiệt phân
1. Tính chất hóa học
a) Tác dụng với axit:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
NaHCO3 + HCl → NaCl + CO2 + H2O
b) Tác dụng với dung dịch bazo:
NaHCO3 + NaOH → Na2CO3 + H2O
c) Phản ứng nhiệt phân:
2NaHCO3 → Na2CO3 + CO2 + H2O
CaCO3 → CaO + CO2
2. Nhận biết
Cho tác dụng với axit → CO2
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
3. Tính chất và ứng dụng của một số muối cacbonat
- Canxi cacbonat (CaCO3) tinh khiết là chất bột nhẹ, màu trắng, dùng làm chất dộn trong cao su và 1 số ngành công nghiệp.
- Natricacbonat (Na2CO3) khan (sođa khan) là chất bột màu trắng, tan nhiều trong nước. Dùng trong công ngiệp thủy tinh, đồ gốm, bột giặt, …
Sơ đồ tư duy: Hợp chất của cacbon
Xemloigiai.com
- Bài 1 trang 75 SGK Hóa học 11
- Bài 2 trang 75 SGK Hóa học 11
- Bài 3 trang 75 SGK Hóa học 11
- Bài 4 trang 75 SGK Hóa học 11
- Bài 5 trang 75 SGK Hóa học 11
- Bài 6 trang 75 SGK Hóa học 11
SGK Hóa lớp 11
Giải bài tập hóa học lớp 11 đầy đủ công thức, lý thuyết, phương trình hóa học, chuyên đề hóa học SGK 11 giúp để học tốt hóa học 11, luyện thi THPT Quốc gia
CHƯƠNG 1: SỰ ĐIỆN LI
- Bài 1. Sự điện li
- Bài 2. Axit, bazơ và muối
- Bài 3. Sự điện li của nước. pH. Chất chỉ thị Axit - bazơ
- Bài 4. Phản ứng trao đổi ion trong dung dịch các chất điện li
- Bài 5. Luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li
- Bài 6. Bài thực hành 1: Tính axit-bazơ. Phản ứng trao đổi ion trong dung dịch các chất điện li
- Đề kiểm tra 15 phút - Chương I - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương I - Hóa học 11
Đề kiểm tra giữa kì - Hóa học 11
CHƯƠNG 2: NITƠ - PHOTPHO
- Bài 7. Nitơ
- Bài 8. Amoniac và muối amoni
- Bài 9. Axit nitric và muối nitrat
- Bài 10. Photpho
- Bài 11. Axit photphoric và muối photphat
- Bài 12. Phân bón hóa học
- Bài 13. Luyện tập: Tính chất của Nitơ, photpho và các hợp chất của chúng
- Bài 14. Bài thực hành 2: Tính chất của một số hợp chất nitơ, photpho
- Đề kiểm tra 15 phút - Chương II - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương II - Hóa học 11
CHƯƠNG 3: CACBON - SILIC
- Bài 15. Cacbon
- Bài 16. Hợp chất của cacbon
- Bài 17. Silic và hợp chất của silic
- Bài 18. Công nghiệp silicat
- Bài 19. Luyện tập: Tính chất của cacbon, silic và các hợp chất của chúng
- Đề kiểm tra 15 phút - Chương III - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương III - Hóa học 11
CHƯƠNG 4: ĐẠI CƯƠNG VỀ HÓA HỌC HỮU CƠ
- Bài 20. Mở đầu về hoá học hữu cơ
- Bài 21. Công thức phân tử hợp chất hữu cơ
- Bài 22. Cấu trúc phân tử hợp chất hữu cơ
- Bài 23. Phản ứng hữu cơ
- Bài 24. Luyện tập: Hợp chất hữu cơ, công thức phân tử và công thức cấu tạo
- Đề kiểm tra 15 phút - Chương IV - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương IV - Hóa học 11
ĐỀ THI HỌC KÌ 1 MỚI NHẤT CÓ LỜI GIẢI
CHƯƠNG 5: HIDROCACBON NO
- Bài 25. Ankan
- Bài 26. Xicloankan
- Bài 27. Luyện tập ankan và xicloankan
- Bài 28. Bài thực hành số 3 : Phân tích định tính nguyên tố. Điều chế và tính chất của metan
- Đề kiểm tra 15 phút - Chương V - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương V - Hóa học 11
CHƯƠNG 6: HIDROCACBON KHÔNG NO
- Bài 29. Anken
- Bài 30. Ankađien
- Bài 31. Luyện tập: Anken và Ankadien
- Bài 32. Ankin
- Bài 33. Luyện tập: Ankin
- Bài 34. Bài thực hành 4 : Điều chế và tính chất của etilen và axetilen
- Đề kiểm tra 15 phút - Chương VI - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương VI - Hóa học 11
CHƯƠNG 7: HIĐROCACBON THƠM, NGUỒN HIĐROCACBON THIÊN NHIÊN. HỆ THỐNG HÓA VỀ HIĐROCACBON
- Bài 35. Benzen và đồng đẳng. Một số hiđrocacbon thơm khác
- Bài 36. Luyện tập: Hiđrocacbon thơm
- Bài 37. Nguồn Hiđrocacbon thiên nhiên
- Bài 38. Hệ thống hóa về hiđrocacbon
- Đề kiểm tra 15 phút - Chương VII - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương VII - Hóa học 11
CHƯƠNG 8: DẪN XUẤT HALOGEN - ANCOL - PHENOL
- Bài 39. Dẫn xuất halogen của hiđrocacbon
- Bài 40. Ancol
- Bài 41. Phenol
- Bài 42. Luyện tập: Dẫn xuất halogen, ancol và phenol
- Bài 43. Bài thực hành 5: Tính chất của etanol, glixerol và phenol
- Đề kiểm tra 15 phút - Chương VIII - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương VIII - Hóa học 11
CHƯƠNG 9: ANĐEHIT - XETON - AXIT CACBOXYLIC
- Bài 44. Anđehit - xeton
- Bài 45. Axit cacboxylic
- Bài 46. Luyện tập: Anđehit - xeton - axit cacboxylic
- Bài 47. Bài thực hành 6: Tính chất của anđehit và axit cacboxylic
- Đề kiểm tra 15 phút - Chương IX - Hóa học 11
- Đề kiểm tra 45 phút (1 tiết) - Chương IX - Hóa học 11
Xem Thêm
Lớp 11 | Các môn học Lớp 11 | Giải bài tập, đề kiểm tra, đề thi Lớp 11 chọn lọc
Danh sách các môn học Lớp 11 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2025 ngắn gọn, chi tiết dễ hiểu.
Toán Học
Vật Lý
Hóa Học
Ngữ Văn
- Soạn văn 11
- SBT Ngữ văn lớp 11
- Văn mẫu 11
- Soạn văn 11 chi tiết
- Soạn văn ngắn gọn lớp 11
- Soạn văn 11 siêu ngắn
Sinh Học
GDCD
Tin Học
Tiếng Anh
Công Nghệ
Lịch Sử & Địa Lý
- Tập bản đồ Địa lí lớp 11
- SBT Địa lí lớp 11
- SGK Địa lí lớp 11
- Tập bản đồ Lịch sử lớp 11
- SBT Lịch sử lớp 11
- SGK Lịch sử lớp 11