Đề số 18 - Đề kiểm tra học kì 1 - Hóa học 12
Đề bài
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Cho các dung dịch : \(HCl,\,AgN{O_3},\,{H_2}S{O_4}\) loãng, \({H_2}S{O_4}\) đặc nguội, \(Cu{(N{O_3})_2},Fe{(N{O_3})_2},\,HN{O_3}\) loãng. Số dung dịch co thể dùng (dư) để thu được Ag tinh khiết từ hỗn hợp rắn gồm Ag, CuO, Fe là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 2. Liên kết hóa học trong tinh thể Na là liên kết giữa
A. các cặp electron dùng chung với các hạt nhân
B. toàn bộ electron tự do với các ion duong natri ở các nút mạng
C. các ion dương với các ion âm
D. cả 3 kiểu trên
Câu 3. Dãy nào gồm các chất rắn không tan trong \({H_2}O,\) nhưng tan trong dung dịch \({H_2}S{O_4}\) loãng dư
\(\begin{array}{l}A.\,CuO,\,Cu,\,Fe,\,Cu{(OH)_2}.\\B.\,\,Na,\,N{a_2}O,\,N{a_2}C{O_3},\,CaC{O_3}\\C.\,Fe,\,FeS,\,F{e_3}{O_4},\,Fe{(OH)_2}\\ D.\,\,Al,\,A{l_2}{O_3},CaO,Mg{(OH)_2}\end{array}\)
Câu 4. Nhúng các thanh Fe giống nhau cùng lúc vào các dung dịch dưới đây. Trường hợp nào thanh Fe bị ăn mòn nhanh nhất?
A. 200 ml dung dịch \({H_2}S{O_4}\) 0,2M.
B. 200 ml dung dịch \({H_2}S{O_4}\) 0,2 M có cho thêm lượng nhỏ \(CuS{O_4}.\)
C. 200 ml dung dịch \({H_2}S{O_4}\) 0,25M.
D. 200 ml dung dịch \({H_2}S{O_4}\) 0,25M có cho thêm lượng nhỏ dung dịch \(ZnS{O_4}.\)
Câu 5. Cho các dung dịch: \(NaOH,\,HCl,\,{C_6}{H_5}OH,\,{C_6}{H_5}N{H_2}\)\(,\,{C_6}{H_5}N{H_3}Cl,B{r_2}\) lần lượt tác dụng với nhau từng đôi một. Số phản ứng xảy ra thuộc loại phản ứng axit – bazơ là
A. 1.
B. 3.
C. 6.
D. 4.
Câu 6. Cho sơ đồ
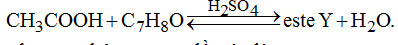
Số công thức cấu tạo của \({C_7}{H_8}O\) chứa vòng benzen thỏa mãn sơ đồ trên là
A. 1.
B. 3.
C. 5.
D. 4.
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1. (2 điểm)
Viết cấu hình eletron của Fe ( Z = 26) và các ion \(F{e^{2 + }},F{e^{3 + }}.\) Từ đó cho biết tính chất hóa học cơ bản của chúng. Mỗi trường hợp viết một phương trình minh họa.
Câu 2. (1,5 điểm)
Viết phương trình hóa học xảy ra khi cho glyxin \(({H_{_2}}N - C{H_2} - COOH)\) lần lượt tác dụng với: dung dịch NaOH, dung dịch HCl, \({C_2}{H_5}OH\) có mặt khí HCl bão hòa.
Câu 3. (1,5 điểm)
Este A có công thức phân tử \({C_3}{H_4}{O_2}.\) Thực hiện các phản ứng sau của A:
+ Cho A tác dụng với dung dịch brom.
+ Cho A tác dụng với dung dịch \(AgN{O_3}\) trong \(N{H_3}\)
+ Đun A với dung dịch NaOH.
Viết các phương trình hóa học xảy ra ở dạng công thức cấu tạo.
Câu 4. (2 điểm)
Cho 28,8 gam hỗn hợp Cu và \(F{e_2}{O_3}\) tác dụng với dung dịch \({H_2}S{O_4}\) loãng dư thu được dung dịch A và 6,4 gam chất rắn không tan.
a) Viết phương trình hóa học xảy ra.
b) Tính thành phần phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Chọn B.
Chỉ dung dịch HCl loãng hoặc \({H_2}S{O_4}\) loãng dùng dư mới hòa tan hết tạp chất cả CuO và Fe, mà không hoàn tan Ag.
Câu 2. Chọn B.
Liên kết hóa học trong tinh thể Na là liên kết kim loại do toàn bộ electron tự do với các ion dương \(N{a^ + }\) ở nút mạng.
Câu 3. Chọn C.
Cu không tan trong cả \({H_2}O\) và dung dịch \({H_2}S{O_4}\) loãng dư \( \Rightarrow \) loại A.
Na và CaO tan trong cả \({H_2}O\) và dung dịch \({H_2}S{O_4}\) loãng dư \( \Rightarrow \) loại B và D.
Câu 4. Chọn B.
Fe bị ăn mòn điện hóa (các trường hợp còn lại là ăn mòn hóa học) do:
Fe đẩy Cu (khỏi \(CuS{O_4}\)) tạo cặp pin Fe – Cu trong đó Fe là cực âm.
Câu 5. Chọn D.
4 phản ứng là phản ứng axit – bazơ là
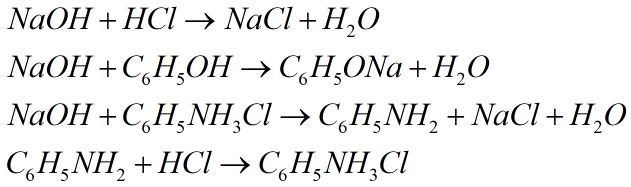
Câu 6. Chọn A.
Chỉ có thể là ancol thơm \({C_6}{H_5}C{H_2}OH\) (duy nhất).
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1. (2 điểm)
\(Fe:\left[ {Ar} \right]3{d^6}4{s^2}\) chất khử trung bình (tác dụng với dung dịch HCl tạo \(F{e^{2 + }}\), tác dụng \(HN{O_3}\) tạo \(F{e^{3 + }}\)): \(Fe + 2{H^ + } \to F{e^{2 + }} + {H_2}\)
Ion \(F{e^{2 + }}:\left[ {Ar} \right]3{d^6}\) là chất khử (tác dụng với chất oxi hóa \(C{l_2},{\rm{dd}}AgN{O_3},...\)) hoặc chất oxi hóa (tác dụng với chất khử là kim loại trước Fe: Al, Zn): \(F{e^{2 + }} + C{l_2} \to F{e^{3 + }} + 2C{l^ - }\)
Ion \(F{e^{3 + }}:\left[ {Ar} \right]3{d^5}\) là chất oxi hóa khá mạnh (tác dụng với chất khử kim loại, KI,…)
Câu 2. (1,5 điểm)

Câu 3. (1,5 điểm)
A là \(HCOOCH = C{H_2}\)
(có hai loại chức: este –COO– và chức anđehit –CH=O và liên kết đôi)
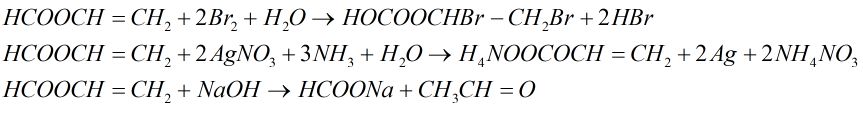
Câu 4. (2 điểm)
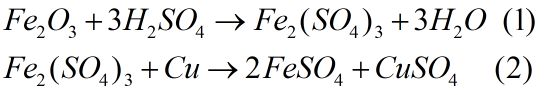
Cu dư 6,4 gam
Theo (1) và (2): số mol Cu tan = số mol \(F{e_2}{O_3}\) trong hỗn hợp = a
\(\begin{array}{l}{m_{F{e_2}{O_3}}} + {m_{Cu(\tan )}} = 28,8 - 6,4 = 22,4\\160a + 64a = 22,4 \Rightarrow a = 0,1mol\end{array}\)
\( \Rightarrow {m_{Cu}}\) trong hỗn hợp là 12,8 gam chiếm 44,44% khối lượng còn \(F{e_2}{O_3}\) chiếm 55,56% khối lượng.
Xemloigiai.com
- Đề cương bài tập ôn tập học kì I Hóa học 12 có lời giải
- Đề số 1 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 2 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 3 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 4 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 5 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 6 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 7 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 8 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 9 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 10 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 11 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 12 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 13 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 14 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 15 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 16 - Đề kiểm tra học kì 1 - Hóa học 12
- Đề số 17 - Đề kiểm tra học kì 1 - Hóa học 12
SGK Hóa lớp 12
Giải bài tập hóa học lớp 12 đầy đủ công thức, lý thuyết, phương trình hóa học, chuyên đề hóa học SGK 12 giúp để học tốt hóa học 12, giúp luyện thi THPT Quốc gia
CHƯƠNG 1. ESTE - LIPIT
- Bài 1. Este - Hóa học 12
- Bài 2. Lipit - Hóa học 12
- Bài 3. Khái niệm về xà phòng và chất giặt rửa tổng hợp
- Bài 4. Luyện tập este và chất béo
- Đề kiểm tra 15 phút - Chương 1 – Hóa học 12
- Đề kiểm tra 45 phút - Chương 1 – Hóa học 12
CHƯƠNG 2. CACBOHIDRAT
- Bài 5. Glucozơ - Hóa học 12
- Bài 6. Saccarozơ, tinh bột và xenlulozơ
- Bài 7. Luyện tập: Cấu tạo và tính chất của Cacbohiđrat
- Bài 8. Thực hành: Điều chế, tính chất hóa học của este và cacbohiđrat
- Đề kiểm tra 15 phút - Chương 2 - Hoá học 12
- Đề kiểm tra 45 phút - Chương 2 – Hóa học 12
CHƯƠNG 3. AMIN, AMINO AXIT VÀ PROTEIN
- Bài 9. Amin
- Bài 10. Amino axit
- Bài 11. Peptit và protein
- Bài 12. Luyện tập: Cấu tạo và tính chất của amin, amino axit và protein
- Đề kiểm tra 15 phút - Chương 3 – Hóa học 12
- Đề kiểm tra 45 phút - Chương 3 – Hóa học 12
CHƯƠNG 4. POLIME VÀ VẬT LIỆU POLIME
- Bài 13. Đại cương về polime
- Bài 14. Vật liệu polime
- Bài 15. Luyện tập: Polime và vật liệu polime
- Bài 16. Thực hành: Một số tính chất của protein và vật liệu polime
- Đề kiểm tra 15 phút – Chương 4 – Hóa học 12
- Đề kiểm tra 45 phút - Chương 4 – Hóa học 12
CHƯƠNG 5. ĐẠI CƯƠNG VỀ KIM LOẠI
- Bài 17. Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
- Bài 18. Tính chất của kim loại. Dãy điện hoá của kim loại
- Bài 19. Hợp kim
- Bài 20. Sự ăn mòn kim loại
- Bài 21. Điều chế kim loại
- Bài 22. Luyện tập: Tính chất của kim loại
- Bài 23. Luyện tập: Điều chế kim loại và sự ăn mòn kim loại
- Bài 24. Thực hành: Tính chất, điều chế kim loại, sự ăn mòn kim loại
- Đề kiểm tra 15 phút - Chương 5 – Hóa học 12
- Đề kiểm tra 45 phút - Chương 5 – Hóa học 12
Đề thi học kì 1 mới nhất có lời giải
CHƯƠNG 6. KIM LOẠI KIỀM, KIM LOẠI KIỀM THỔ, NHÔM
- Bài 25. Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
- Bài 26. Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ
- Bài 27. Nhôm và hợp chất của nhôm
- Bài 28. Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
- Bài 29. Luyện tập: Tính chất của nhôm và hợp chất của nhôm
- Bài 30. Thực hành: Tính chất của natri, magie, nhôm và hợp chất của chúng
- Đề kiểm tra 15 phút - Chương 6 – Hóa học 12
- Đề kiểm tra 45 phút (1 tiết ) – Chương 6 – Hóa học 12
CHƯƠNG 7. SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG
- Bài 31. Sắt
- Bài 32. Hợp chất của sắt
- Bài 33. Hợp kim của sắt
- Bài 34. Crom và hợp chất của Crom
- Bài 35. Đồng và hợp chất của đồng
- Bài 36. Sơ lược về Niken, Kẽm, Chì, Thiếc
- Bài 37. Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
- Bài 38. Luyện tập: Tính chất hóa học của Crom, đồng và hợp chất của chúng
- Bài 39. Thực hành: Tính chất hóa học của sắt, đồng và nhưng hợp chất của sắt, crom
- Đề kiểm tra 15 phút - Chương 7 – Hóa học 12
- Đề kiểm tra 45 phút (1 tiết ) – Chương 7 – Hóa học 12
CHƯƠNG 8. PHÂN BIỆT MỘT SỐ CHẤT VÔ CƠ
- Bài 40. Nhận biết một số ion trong dung dịch
- Bài 41. Nhận biết một số chất khí
- Bài 42. Luyện tập: Nhận biết một số chất vô cơ
- Đề kiểm tra 15 phút - Chương 8 – Hóa học 12
- Đề kiểm tra 45 phút (1 tiết ) – Chương 8 – Hóa học 12
CHƯƠNG 9. HÓA HỌC VÀ VẤN ĐỀ PHÁT TRIỂN KINH TẾ, XÃ HỘI, MÔI TRƯỜNG - HÓA 12
- Bài 43. Hóa học và vấn để phát triển kinh tế
- Bài 44. Hóa học và vấn đề xã hội
- Bài 45. Hóa học và vấn đề môi trường
- Đề kiểm tra 15 phút - Chương 9 – Hóa học 12
ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 12
Xem Thêm
- ĐỀ THI THỬ THPT QUỐC GIA MÔN HÓA HỌC
- Câu hỏi tự luyện Hóa 12
- Đề thi giữa kì 1 Hóa 12
- Đề kiểm tra giữa học kì II - Hóa học 12
- Đề thi thử THPTQG các trường
- Đề thi học kì 2 Hóa 12
- Đề thi giữa kì 2 Hóa 12
- Đề thi học kì 1 Hóa 12
- Đề thi giữa học kì 1 Hóa 12
- Đề kiểm tra 1 tiết Hóa 12
- Đề kiểm tra 15 phút Hóa 12
- Đề khảo sát chất lượng đầu năm Hóa 12
Lớp 12 | Các môn học Lớp 12 | Giải bài tập, đề kiểm tra, đề thi Lớp 12 chọn lọc
Danh sách các môn học Lớp 12 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2025 ngắn gọn, chi tiết dễ hiểu.
Toán Học
Vật Lý
Hóa Học
Ngữ Văn
- Soạn văn 12
- SBT Ngữ văn lớp 12
- Văn mẫu 12
- Soạn văn 12 chi tiết
- Soạn văn ngắn gọn lớp 12
- Soạn văn 12 siêu ngắn
Sinh Học
GDCD
Tin Học
Tiếng Anh
- SBT Tiếng Anh lớp 12
- Ngữ pháp Tiếng Anh
- SGK Tiếng Anh 12
- SBT Tiếng Anh lớp 12 mới
- SGK Tiếng Anh 12 Mới
Công Nghệ
Lịch Sử & Địa Lý
- Tập bản đồ Địa lí lớp 12
- SBT Địa lí lớp 12
- SGK Địa lí lớp 12
- Tập bản đồ Lịch sử lớp 12
- SBT Lịch sử lớp 12
- SGK Lịch sử lớp 12