Bài 4. Ôn tập chương 1 trang 10, 11, 12 SBT Hóa 10 Kết nổi tri thức
4.1
Số proton, neutron và electron của \({}_{24}^{52}C{r^{3 + }}\) lần lượt là
A. 24, 28, 24.
B. 24, 28, 21.
C. 24, 30, 21.
D. 24, 28, 27.
Phương pháp giải:
Dựa vào
- Kí hiệu nguyên tử: \({}_Z^AX\) trong đó
+ X là kí hiệu nguyên tố hóa học
+ Z là số hiệu nguyên tử (= số proton)
+ A là số khối
Lời giải chi tiết:
- Từ kí hiệu nguyên tử \({}_{24}^{52}C{r^{3 + }}\)ta có p = 24 => n = 52 - 24 = 28 và e = 24 - 3 = 21
=> Đáp án: B
4.2
Tổng số hạt neutron, proton, electron trong ion ở \({}_{17}^{35}C{l^ - }\) là
A. 52.
B. 35.
C. 53.
D. 51.
Phương pháp giải:
Dựa vào
- Kí hiệu nguyên tử: \({}_Z^AX\) trong đó
+ X là kí hiệu nguyên tố hóa học
+ Z là số hiệu nguyên tử (= số proton)
+ A là số khối
Lời giải chi tiết:
- Từ kí hiệu nguyên tử \({}_{17}^{35}C{l^ - }\)ta có p = 17 => e = 17 + 1 = 18
=> Tổng số hạt p, n, e trong \({}_{17}^{35}C{l^ - }\)là 35 + 18 = 53
=> Đáp án: C
4.3
Nguyên tử của nguyên tố M có số hiệu nguyên tử bằng 20. Cấu hình electron của ion M2+ là
A. 1s22s22p63s23p6.
B. 1s22s22p63s23p64s1.
C. 1s22s22p63s23p63d1.
D. 1s22s22p63s23p64s2.
Phương pháp giải:
Dựa vào
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
- Viết cấu hình electron của ion nguyên tử:
+ Nếu ion mang điện tích dương => bớt đi bấy nhiêu electron ở phân lớp ngoài cùng
+ Nếu ion mang điện tích âm => thêm vào bấy nhiêu electron ở phân lớp ngoài cùng
Lời giải chi tiết:
- Nguyên tử của nguyên tố M có Z = 20
=> Phân mức năng lượng electron: 1s22s22p63s23p64s2
=> Cấu hình electron của nguyên tử M là 1s22s22p63s23p64s2
=> Cấu hình electron của nguyên tử M2+ là 1s22s22p63s23p6
=> Đáp án: A
4.4
Anion X2- có cấu hình electron là 1s22s22p6. Cấu hình electron của X là
A. 1s22s2.
B. 1s22s22p63s2.
C. 1s22s22p4.
D. 1s22s22p53s1
Phương pháp giải:
Dựa vào
- Viết cấu hình electron của ion nguyên tử:
+ Nếu ion mang điện tích dương => bớt đi bấy nhiêu electron ở phân lớp ngoài cùng
+ Nếu ion mang điện tích âm => thêm vào bấy nhiêu electron ở phân lớp ngoài cùng
Lời giải chi tiết:
- Anion X2- có cấu hình electron là 1s22s22p6 => Cấu hình electron của nguyên tử X là 1s22s22p4
=> Đáp án: C
4.5
Ion O2- không có cùng số electron với nguyên tử hoặc ion nào sau đây
A. Ne.
B. F-.
C. Cl-.
D. Mg2+.
Phương pháp giải:
Dựa vào
- Cấu hình electron của ion nguyên tử:
+ Nếu ion mang điện tích dương => bớt đi bấy nhiêu electron ở phân lớp ngoài cùng
+ Nếu ion mang điện tích âm => thêm vào bấy nhiêu electron ở phân lớp ngoài cùng
Lời giải chi tiết:
- Nguyên tử của nguyên tố O có Z = 8
=> Nguyên tử O2- có 8 + 2 = 10 electron
- Nguyên tử của nguyên tố Ne có Z = 10
=> Nguyên tử Ne có 10 electron
- Nguyên tử của nguyên tố F có Z = 9
=> Nguyên tử F- có 9 + 1 = 10 electron
- Nguyên tử của nguyên tố Cl có Z = 17
=> Nguyên tử Cl- có 17 + 1 = 18 electron
- Nguyên tử của nguyên tố Mg có Z = 12
=> Nguyên tử Mg2+ có 12 - 2 = 10 electron
=> Đáp án: C
4.6
Anion X2- có cấu hình electron lớp ngoài cùng là 3s23p6. Tổng số electron ở lớp vỏ của X2- là
A. 18.
B. 16.
C. 9.
D. 20.
Phương pháp giải:
Dựa vào
- Khi có cấu hình electron lớp ngoài cùng của nguyên tử
+ TH1: các lớp trước đó đã được lấp đầy electron
+ TH2: trước lớp ngoài cùng vẫn có lớp chưa được lấp đầy electron (do có phân lớp d hoặc phân lớp f). Áp dụng với nguyên tử có cấu hình electron lớp ngoài cùng từ 4s trở lên
Lời giải chi tiết:
- Anion X2- có cấu hình electron lớp ngoài cùng là 3s23p6
- Lớp thứ nhất có 1 phân lớp s => Lớp thứ nhất có tối đa: 1.2 = 2 electron
- Lớp thứ hai có 2 phân lớp s, p => Lớp thứ hai có tối đa: 1.2 + 3.2 = 8 electron
=> Anion X2- có tổng cộng: 2 + 8 + 8 = 18 electron
=> Đáp án: A
4.7
Nguyên tử của nguyên tố M có cấu hình electron là 1s22s22p4. Số electron độc thân của M là
A. 3.
B. 2.
C. 1.
D. 0.
Phương pháp giải:
Dựa vào
- Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau
- Quy tắc Hund: Trong cùng một phân lớp bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa
Lời giải chi tiết:
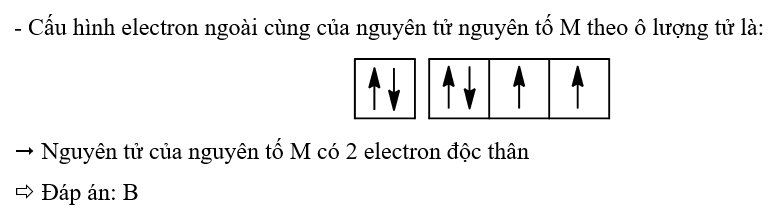
4.8
Nguyên tố Q có số hiệu nguyên tử bằng 14. Electron cuối cùng của nguyên tử nguyên tố Q điển vào lớp, phân lớp nào sau đây?
A. K, s.
B. L, p.
C. M, p.
D. N, d.
Phương pháp giải:
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
- Cách gọi tên và đánh số các lớp
Lớp | K | L | M | N | O | P | Q |
Thứ tự | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Lời giải chi tiết:
- Nguyên tử của nguyên tố Q có Z = 14
=> Phân mức năng lượng electron: 1s22s22p63s23p2
=> Cấu hình electron của nguyên tử Q là 1s22s22p63s23p2
=> Đáp án: C
4.9
Nguyên tử của nguyên tố Y có 14 electron ở lớp thứ ba. Thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng là 1s2s2p3s3p4s3d… Cấu hình electron của nguyên tử Y là
A. 1s22s22p63s24s23p6.
B. 1s22s22p63s23p63d64s2.
C. 1s22s22p63s23p63d8.
D. 1s22s22p63s23p63d6.
Phương pháp giải:
- Khi có cấu hình electron lớp ngoài cùng của nguyên tử
+ TH1: các lớp trước đó đã được lấp đầy electron
+ TH2: trước lớp ngoài cùng vẫn có lớp chưa được lấp đầy electron (do có phân lớp d hoặc phân lớp f). Áp dụng với nguyên tử có cấu hình electron lớp ngoài cùng từ 4s trở lên
Lời giải chi tiết:
- Nguyên tử của nguyên tố Y có 14 electron ở lớp thứ ba => Các lớp thứ nhất, lớp thứ hai và phân lớp 4s đã điền tối đa số electron
=> Phân mức năng lượng electron là 1s22s22p63s23p64s23d6
=> Cấu hình electron của nguyên tử Q là 1s22s22p63s23p63d64s2
=> Đáp án: B
4.10
Nguyên tử của nguyên tố X có cấu hình electron đã xây dựng đến phân lớp 3d2. Tổng số electron của nguyên tử nguyên tố X là
A. 18.
B. 20.
C. 22.
D. 24.
Phương pháp giải:
Dựa vào
- Khi có cấu hình electron lớp ngoài cùng của nguyên tử
+ TH1: các lớp trước đó đã được lấp đầy electron
+ TH2: trước lớp ngoài cùng vẫn có lớp chưa được lấp đầy electron (do có phân lớp d hoặc phân lớp f). Áp dụng với nguyên tử có cấu hình electron lớp ngoài cùng từ 4s trở lên
Lời giải chi tiết:
- Nguyên tử của nguyên tố X có cấu hình electron đã xây dựng đến phân lớp 3d2 => Các lớp thứ nhất, lớp thứ hai và phân lớp 4s đã điền tối đa số electron
=> Phân mức năng lượng electron là 1s22s22p63s23p64s23d2
=> Tổng số electron của nguyên tử nguyên tố X là 2 + 8 + 10 + 2 = 22
=> Đáp án: C
4.11
Ion nào sau đây không có cấu hình electron của khí hiếm?
A. Na+.
B. Al3+
C. Cl-.
D. Fe2+.
Phương pháp giải:
Dựa vào
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
- Viết cấu hình electron của ion nguyên tử:
+ Nếu ion mang điện tích dương => bớt đi bấy nhiêu electron ở phân lớp ngoài cùng
+ Nếu ion mang điện tích âm => thêm vào bấy nhiêu electron ở phân lớp ngoài cùng
Lời giải chi tiết:
- Nguyên tử của nguyên tố Na có Z = 11
=> Phân mức năng lượng electron: 1s22s22p63s1
=> Cấu hình electron của nguyên tử Na là 1s22s22p63s1
=> Cấu hình electron của nguyên tử Na+ là 1s22s22p6
- Nguyên tử của nguyên tố Al có Z = 13
=> Phân mức năng lượng electron: 1s22s22p63s23p1
=> Cấu hình electron của nguyên tử Al là 1s22s22p63s23p1
=> Cấu hình electron của nguyên tử Al3+ là 1s22s22p6
- Nguyên tử của nguyên tố Cl có Z = 17
=> Phân mức năng lượng electron: 1s22s22p63s23p5
=> Cấu hình electron của nguyên tử Cl là 1s22s22p63s23p5
=> Cấu hình electron của nguyên tử Cl- là 1s22s22p63s23p6
- Nguyên tử của nguyên tố Fe có Z = 26
=> Phân mức năng lượng electron: 1s22s22p63s23p64s23d6
=> Cấu hình electron của nguyên tử Fe là 1s22s22p63s23p63d64s2
=> Cấu hình electron của nguyên tử Fe2+ là 1s22s22p63s23p63d6
=> Đáp án: D
4.12
Nguyên tử của nguyên tố X có electron cuối cùng điền vào phân lớp 3p1. Nguyên tử của nguyên tố Y có electron cuối cùng điền vào phân lớp 3p3. Số proton của X và Y lần lượt là
A. 13 và 15.
B. 12 và 14.
C. 13 và 14.
D. 12 và 15.
Phương pháp giải:
- Khi có cấu hình electron lớp ngoài cùng của nguyên tử
+ TH1: các lớp trước đó đã được lấp đầy electron
+ TH2: trước lớp ngoài cùng vẫn có lớp chưa được lấp đầy electron (do có phân lớp d hoặc phân lớp f). Áp dụng với nguyên tử có cấu hình electron lớp ngoài cùng từ 4s trở lên
Lời giải chi tiết:
- Nguyên tử của nguyên tố X có electron cuối cùng điền vào phân lớp 3p1 " Các lớp thứ nhất, lớp thứ hai đã điền tối đa số electron
=> Phân mức năng lượng electron là 1s22s22p63s23p1
=> Tổng số proton của nguyên tử nguyên tố X là 2 + 8 + 3 = 13
- Nguyên tử của nguyên tố Y có electron cuối cùng điền vào phân lớp 3p3 " Các lớp thứ nhất, lớp thứ hai đã điền tối đa số electron
=> Phân mức năng lượng electron là 1s22s22p63s23p3
=> Tổng số proton của nguyên tử nguyên tố Y là 2 + 8 + 5 = 15
=> Đáp án: A
4.13
Cho các nguyên tố có điện tích hạt nhân như sau: Z = 7, Z = 14 và Z = 21. Biểu diễn cấu hình electron của nguyên tử theo ô orbital. Tại sao lại phân bố như vậy?
Phương pháp giải:
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
- Viết cấu hình electron theo ô lượng tử:
+ Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau
+ Quy tắc Hund: Trong cùng một phân lớp bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa
Lời giải chi tiết:
- Nguyên tử có Z = 7
=> Phân mức năng lượng electron: 1s22s22p3
=> Cấu hình electron của nguyên tử là: 1s22s22p3
=> Cấu hình electron theo ô lượng tử
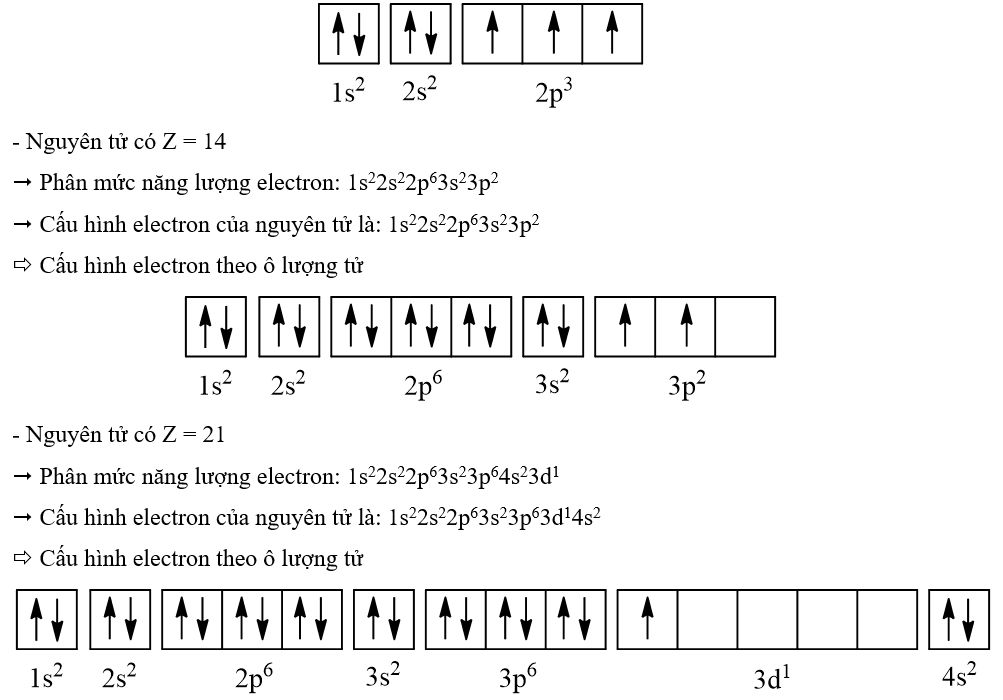
4.14
Cho các nguyên tố có điện tích hạt nhân như sau Z = 9; Z = 16, Z = 18, Z = 20 và Z = 29 Các nguyên tố trên là kim loại, phi kim hay khi hiếm?
Phương pháp giải:
Dựa vào
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
- Dự đoán tính kim loại/ phi kim của nguyên tử
+ Đối với các nguyên tố nhóm A (bao gồm các nguyên tố s và p)
+ Đối với các nguyên tố nhóm B (bao gồm các nguyên tố d và f): các nguyên tố nhóm B đều là kim loại và được gọi là các kim loại chuyển tiếp
Lời giải chi tiết:
- Nguyên tử có Z = 9
=> Phân mức năng lượng electron: 1s22s22p5
=> Cấu hình electron của nguyên tử là: 1s22s22p5
=> Nguyên tử có Z = 9 có 7 electron lớp ngoài cùng nên là nguyên tố phi kim
- Nguyên tử có Z = 16
=> Phân mức năng lượng electron: 1s22s22p63s23p4
=> Cấu hình electron của nguyên tử là: 1s22s22p63s23p4
=> Nguyên tử có Z = 16 có 6 electron lớp ngoài cùng nên là nguyên tố phi kim
- Nguyên tử có Z = 18
=> Phân mức năng lượng electron: 1s22s22p63s23p6
=> Cấu hình electron của nguyên tử là: 1s22s22p63s23p6
=> Nguyên tử có Z = 18 có 8 electron lớp ngoài cùng nên là nguyên tố khí hiếm
- Nguyên tử có Z = 20
=> Phân mức năng lượng electron: 1s22s22p63s23p64s2
=> Cấu hình electron của nguyên tử là: 1s22s22p63s23p64s2
=> Nguyên tử có Z = 20 có 2 electron lớp ngoài cùng nên là nguyên tố kim loại
- Nguyên tử có Z = 29
=> Phân mức năng lượng electron: 1s22s22p63s23p64s13d10
=> Cấu hình electron của nguyên tử là: 1s22s22p63s23p63d104s1
=> Nguyên tử có Z = 29 thuộc nhóm B nên là nguyên tố kim loại
4.15
Tổng số hạt cơ bản của nguyên tử X là 13. Cấu hình electron của nguyên tử X là
A. 1s22s22p3.
B. 1s22s22p2.
C. 1s22s22p1.
D. 1s22s2.
Phương pháp giải:
Dựa vào mối liên hệ giữa các hạt proton (p), neutron (n) và electron (e) trong nguyên tử:
- Tổng số hạt trong nguyên tử = p + n + e
- Điều kiện bền của nguyên tử: số p ≤ số n ≤ 1,5.số p (áp dụng với các nguyên tố có p < 82)
Lời giải chi tiết:
- Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là p, e, n
- Có tổng số hạt cơ bản của nguyên tử X là 13 => 2p + n = 13 (do p = e)
- Có số p ≤ số n ≤ 1,5.số p => p ≤ 13 - 2p ≤ 1,5p => \(\frac{{13}}{{3,5}}\) ≤ p ≤ \(\frac{{13}}{3}\)
=> p = e = 4
- Nguyên tử X có Z = 4
=> Phân mức năng lượng electron: 1s22s2
=> Cấu hình electron của nguyên tử là: 1s22s2
=> Đáp án: D
4.16
Cho nguyên tử R có tổng số hạt cơ bản là 46, số hạt mang điện nhiều hơn số hạt không mang điện là 14. Cấu hình electron nguyên tử của R là
A. (Ne)3s23p3.
B. (Ne)3s23p5.
C. (Ar)3d14s2.
D. (Ar)4s2.
Phương pháp giải:
Dựa vào mối liên hệ giữa các hạt proton (p), neutron (n) và electron (e) trong nguyên tử:
- Tổng số hạt trong nguyên tử = p + n + e
- Trong nguyên tử trung hòa về điện có p = e
- Số hạt không mang điện = n
- Proton mang điện tích dương, electron mang điện tích âm
* Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
Lời giải chi tiết:
- Gọi số hạt proton, electron và neutron trong nguyên tử R lần lượt là p, e, n
- Nguyên tử R có tổng số hạt cơ bản là 46 => 2p + n = 46 (1) (do p = e)
- Số hạt mang điện nhiều hơn số hạt không mang điện là 14 => 2p - n = 14 (2) (do p = e)
=> Từ (1), (2) giải hệ hai phương trình hai ẩn ta có p = e = 15, n = 16
- Nguyên tử R có Z = 15
=> Phân mức năng lượng electron: 1s22s22p63s23p3
=> Cấu hình electron của nguyên tử là: 1s22s22p63s23p3 hay (Ne)3s23p3
=> Đáp án: A
4.17
Nguyên tố X được sử dụng rộng rãi trong đời sống: đúc tiền, làm đồ trang sức, làm răng giả,... Muối iodide của X được sử dụng nhằm tụ mây tạo ra mưa nhân tạo. Tổng số hạt cơ bản trong nguyên tử nguyên tố X là 155, số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt. Xác định nguyên tố X.
Phương pháp giải:
Dựa vào mối liên hệ giữa các hạt proton (p), neutron (n) và electron (e) trong nguyên tử:
- Tổng số hạt trong nguyên tử = p + n + e
- Trong nguyên tử trung hòa về điện có p = e
- Số hạt không mang điện = n
- Proton mang điện tích dương, electron mang điện tích âm
Lời giải chi tiết:
- Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là p, e, n
- Nguyên tử X có tổng số hạt cơ bản là 155 => 2p + n = 155 (1) (do p = e)
- Số hạt mang điện nhiều hơn số hạt không mang điện là 33 => 2p - n = 33 (2) (do p = e)
=> Từ (1), (2) giải hệ hai phương trình hai ẩn ta có p = e = 47, n = 61
=> A = 47 + 61 = 108 ð X là silver (Ag)
4.18
Nguyên tử nguyên tố X có tổng số hạt cơ bản là 82. Số hạt mang điện nhiều hơn số hạt không mang điện là 22.
a) Viết kí hiệu nguyên tử của nguyên tố X.
b) Xác định số lượng các hạt cơ bản trong ion X2+ và viết cấu hình electron của ion đó.
Phương pháp giải:
Dựa vào mối liên hệ giữa các hạt proton (p), neutron (n) và electron (e) trong nguyên tử:
- Tổng số hạt trong nguyên tử = p + n + e
- Trong nguyên tử trung hòa về điện có p = e
- Số hạt không mang điện = n
- Proton mang điện tích dương, electron mang điện tích âm
* Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
- Viết cấu hình electron của ion nguyên tử:
+ Nếu ion mang điện tích dương => bớt đi bấy nhiêu electron ở phân lớp ngoài cùng
+ Nếu ion mang điện tích âm => thêm vào bấy nhiêu electron ở phân lớp ngoài cùng
Lời giải chi tiết:
a) - Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là p, e, n
- Nguyên tử X có tổng số hạt cơ bản là 82 => 2p + n = 82 (1) (do p = e)
- Số hạt mang điện nhiều hơn số hạt không mang điện là 22 => 2p - n = 22 (2) (do p = e)
=> Từ (1), (2) giải hệ hai phương trình hai ẩn ta có p = e = 26, n = 30
=> A = 26 + 30 = 56 => X là iron (Fe)
b) - Nguyên tử của nguyên tố Fe có Z = 26
=> Phân mức năng lượng electron: 1s22s22p63s23p64s23d6
=> Cấu hình electron của nguyên tử Fe là 1s22s22p63s23p63d64s2
=> Cấu hình electron của nguyên tử Fe2+ là 1s22s22p63s23p63d6
=> Số lượng các hạt cơ bản trong Fe2+ là: 26 proton, 30 neutron và 26 - 2 = 24 electron
4.19
Trong tự nhiên, hợp chất X tồn tại ở dạng quặng có công thức ABY2. X được khai thác và sử dụng nhiều trong luyện kim hoặc sản xuất acid. Trong phân tử X, nguyên tử của hai nguyên tố A và B đều có phân lớp ngoài cùng là 4s, các ion A2+, B2+ có số electron lớp ngoài cùng lần lượt là 17 và 14. Tổng số proton trong X là 87.
a) Viết cấu hình electron nguyên tử của A và B.
b) Xác định X.
Phương pháp giải:
Dựa vào
Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
- Viết cấu hình electron của ion nguyên tử:
+ Nếu ion mang điện tích dương => bớt đi bấy nhiêu electron ở phân lớp ngoài cùng
+ Nếu ion mang điện tích âm => thêm vào bấy nhiêu electron ở phân lớp ngoài cùng
Lời giải chi tiết:
a) - Nguyên tử của hai nguyên tố A và B đều có phân lớp ngoài cùng là 4s, các ion A2+, B2+ có số electron lớp ngoài cùng lần lượt là 17 và 14.
* Xét nguyên tố A:
- Trường hợp 1: Nguyên tử của nguyên tố A có phân lớp 4s1
=> Nguyên tử của nguyên tố A có 17 + 2 - 1 = 18 electron ở lớp 3
=> Cấu hình electron của nguyên tử A là 1s22s22p63s23p63d104s1
=> Nguyên tử của nguyên tố A có tổng cộng: 2 + 8 + 18 + 1 = 29 electron
=> A là nguyên tố copper (Cu)
- Trường hợp 2: Nguyên tử của nguyên tố A có phân lớp 4s2
=> Nguyên tử của nguyên tố A có 17 + 2 - 2 = 17 electron ở lớp 3
=> Cấu hình electron của nguyên tử A là 1s22s22p63s23p63d94s2 (không bền vững)
* Xét nguyên tố B:
- Trường hợp 1: Nguyên tử của nguyên tố B có phân lớp 4s1
=> Nguyên tử của nguyên tố B có 14 + 2 - 1 = 15 electron ở lớp 3
=> Cấu hình electron của nguyên tử B là 1s22s22p63s23p63d74s2 (không bền vững)
- Trường hợp 2: Nguyên tử của nguyên tố B có phân lớp 4s2
=> Nguyên tử của nguyên tố B có 14 + 2 - 2 = 14 electron ở lớp 3
=> Cấu hình electron của nguyên tử B là 1s22s22p63s23p63d64s2
=> Nguyên tử của nguyên tố B có tổng cộng: 2 + 8 + 15 + 1 = 26 electron
=> B là nguyên tố iron (Fe)
b) - Tổng số proton trong X là 87 => Số proton trong Y = \(\frac{{87 - 26 - 29}}{2} = 16\)
=> Y là nguyên tố sulfur (S)
=> Quặng X có công thức là CuFeS2
- Bài 1. Thành phần của nguyên tử trang 4, 5 SBT Hóa 10 Kết nổi tri thức
- Bài 2. Nguyên tố hóa học trang 6, 7 SBT Hóa 10 Kết nổi tri thức
- Bài 3. Cấu trúc lớp vỏ electron nguyên tử trang 7, 8, 9 SBT Hóa 10 Kết nổi tri thức
SBT Hóa 10 - Kết nối tri thức
Để học tốt SBT Hóa 10 - Kết nối tri thức, loạt bài giải bài tập SBT Hóa 10 - Kết nối tri thức đầy đủ kiến thức, lý thuyết và bài tập được biên soạn bám sát theo nội dung sách giáo khoa Lớp 10.
Lớp 10 | Các môn học Lớp 10 | Giải bài tập, đề kiểm tra, đề thi Lớp 10 chọn lọc
Danh sách các môn học Lớp 10 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2025 ngắn gọn, chi tiết dễ hiểu.
Toán Học
- SBT Toán 10 Nâng cao
- Chuyên đề học tập Toán 10 - Cánh diều
- Chuyên đề học tập Toán 10 - Chân trời sáng tạo
- Chuyên đề học tập Toán 10 - Kết nối tri thức
- SBT Toán 10 - Chân trời sáng tạo
- SBT Toán 10 - Kết nối tri thức
- SGK Toán 10 - Cánh diều
- SGK Toán 10 - Chân trời sáng tạo
- SGK Toán 10 - Kết nối tri thức
Vật Lý
- SBT Vật lí 10 - Chân trời sáng tạo
- SBT Vật lí 10 - Kết nối tri thức
- SGK Vật Lí 10 - Cánh diều
- SGK Vật Lí 10 - Chân trời sáng tạo
- SGK Vật Lí 10 - Kết nối tri thức
Hóa Học
- SBT Hóa học 10 Nâng cao
- Chuyên đề học tập Hóa 10 - Cánh diều
- Chuyên đề học tập Hóa 10 – Chân trời sáng tạo
- Chuyên đề học tập Hóa 10 - Kết nối tri thức
- SBT Hóa 10 - Chân trời sáng tạo
- SBT Hóa 10 - Kết nối tri thức
- SGK Hóa 10 - Cánh diều
- SGK Hóa 10 - Chân trời sáng tạo
- SGK Hóa 10 - Kết nối tri thức
Ngữ Văn
- Soạn văn 10
- SBT Ngữ văn lớp 10
- SBT Văn 10 - Cánh diều
- SBT Văn 10 - Chân trời sáng tạo
- SBT Văn 10 - Kết nối tri thức
- Soạn văn 10 - Cánh Diều - chi tiết
- Soạn văn 10 - Cánh Diều - siêu ngắn
- Soạn văn 10 - Chân trời sáng tạo - chi tiết
- Soạn văn 10 - Chân trời sáng tạo - siêu ngắn
- Soạn văn 10 - Kết nối tri thức - chi tiết
- Soạn văn 10 - Kết nối tri thức - siêu ngắn
Sinh Học
- Chuyên đề học tập Sinh 10 - Chân trời sáng tạo
- Chuyên đề học tập Sinh 10 - Kết nối tri thức
- SBT Sinh lớp 10 - Cánh diều
- SBT Sinh lớp 10 - Chân trời sáng tạo
- SBT Sinh lớp 10 - Kết nối tri thức
- SGK Sinh 10 - Cánh diều
- SGK Sinh 10 - Chân trời sáng tạo
- SGK Sinh 10 - Kết nối tri thức
GDCD
- SGK Giáo dục quốc phòng và an ninh 10 - Cánh diều
- SGK Giáo dục quốc phòng và an ninh 10 - Kết nối tri thức
- SGK Giáo dục thể chất 10 - Cánh diều
- SGK Giáo dục thể chất 10 - Kết nối tri thức
- SGK Giáo dục kinh tế và pháp luật 10 - Cánh diều
- SGK Giáo dục kinh tế và pháp luật 10 - Chân trời sáng tạo
- SGK Giáo dục kinh tế và pháp luật 10 - Kết nối tri thức
Tin Học
Tiếng Anh
- SBT Tiếng Anh lớp 10
- SBT Tiếng Anh 10 - English Discovery
- SBT Tiếng Anh 10 - Bright
- SBT Tiếng Anh 10 - iLearn Smart World
- SBT Tiếng Anh 10 - Friends Global (Chân trời sáng tạo)
- SBT Tiếng Anh 10 - Global Success (Kết nối tri thức)
- Tiếng Anh 10 - Bright
- Tiếng Anh 10 - Explore New Worlds
- Tiếng Anh 10 - English Discovery
- Tiếng Anh 10 - iLearn Smart World
- Tiếng Anh 10 - Friends Global
- Tiếng Anh 10 - Global Success
Công Nghệ
Lịch Sử & Địa Lý
- Tập bản đồ Địa lí lớp 10
- SBT Địa lí 10 - Chân trời sáng tạo
- SBT Địa lí 10 - Kết nối tri thức
- SGK Địa lí lớp 10 - Cánh Diều
- SGK Địa lí lớp 10 - Kết nối tri thức
- SGK Địa lí lớp 10 - Chân trời sáng tạo
- Tập bản đồ Lịch sử lớp 10
- SGK Lịch sử 10 - Cánh Diều
- SGK Lịch sử 10 - Chân trời sáng tạo
- SGK Lịch sử 10 - Kết nối tri thức