Lý thuyết sơ lược về bảng tuần hoàn các nguyên tố hoá học
I. NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
II. CẤU TẠO BẢNG TUẦN HOÀN
1. Ô nguyên tố
- Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó.

- Số hiệu nguyên tử có số trị bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử. Số hiệu nguyên tử trùng với số thứ tự ô trong bảng tuần hoàn.
Ví dụ: Ô thứ 11, xếp nguyên tố natri (Na).
Ta có:
+ Số hiệu nguyên tử = số proton = số electron = 11
+ Kí hiệu hóa học: Na
+ Tên nguyên tố: natri
+ Nguyên tử khối: 23
2. Chu kì
- Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp theo chiều điện tích hạt nhân tăng dần.
- Số thứ tự chu kì bằng số lớp electron.
- Bảng tuần hoàn gồm có 7 chu kỳ: chu kỳ 1, 2, 3 là các chu kỳ nhỏ. Chu kỳ 4, 5, 6, 7 là các chu kỳ lớn.
Ví dụ: chu kì 3: bắt đầu là kim loại kiềm Na và kết thúc là khí trơ: Ar (agon)
- Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau, do đó có tính chất tương tự nhau được xếp thành một cột theo chiều tăng của điện tích hạt nhân nguyên tử.
- Số thứ tự của các nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử trong nhóm đó.
Ví dụ:
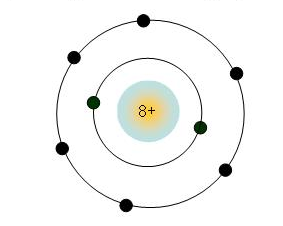
+ Nhóm IA: Gồm các nguyên tố kim loại hoạt động mạnh. Nguyên tử của chúng đều có 1 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ Li (3+), … đến Fr (87+).
+ Mô phỏng cấu tạo nguyên tử Kali ở nhóm IA, có 1 electron ở lớp ngoài cùng:

III. SỰ BIỂN ĐỔI TÍNH CHẤT CỦA CÁC NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
1. Trong một chu kì
- Trong một chu kỳ, khi đi từ đầu đến cuối chu kỳ theo chiều tăng của điện tích hạt nhân:
+ Số e lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
+ Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần.
Ví dụ:
Chu kì 2 gồm 8 nguyên tố:
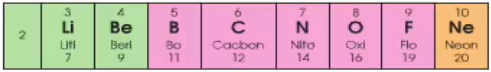
+ Số e lớp ngoài cùng của nguyên tử các nguyên tố trong chu kỳ 2 tăng dần từ 1 đến 8
+ Đẩu chu kỳ 2 là một kim loại mạnh (Li), cuối chu kỳ là một phi kim mạnh (F), kết thúc chu kỳ là một khí hiếm (Ne).
2. Trong một nhóm
Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân.
- Số lớp electron của nguyên tử tăng dần.
- Tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
Ví dụ: Nhóm IA gồm 6 nguyên tố từ Li đến Fr
+ Số lớp electron tăng dần từ 2 đến 7. Số electron lớp ngoài cùng của nguyên tử đều bằng 1.
+ Tính kim loại của các nguyên tố tăng dần. Đầu nhóm IA, Li là kim loại hoạt động hóa học mạnh cuối nhóm là kim loại Fr hoạt động hóa học rất mạnh
IV. Ý NGHĨA CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
1. Biết vị trí của nguyên tố ta có thể suy đoán cấu tạo nguyên tử và tính chất của nguyên tố.
Ví dụ:
Biết: Nguyên tố A có số hiệu nguyên tử là 17, chu kì 3, nhóm VIIA.
Xác định được:
+ Nguyên tố A có số hiệu nguyên tử là 17, suy ra điện tích hạt nhân của nguyên tử A là 17+, nguyên tử A có 17 electron.
+ A ở chu kì 3, suy ra nguyên tử A có 3 lớp electron. Vì ở gần cuối chu kì 3 nên A là một phi kim mạnh, tính phi kim của A mạnh hơn của nguyên tố trước nó trong cùng chu kì (là S có số hiệu là 16).
+ A ở nhóm VIIA nên lớp ngoài cùng có 7 electron, tính phi kim của A yếu hơn của nguyên tố phía trên nó trong cùng nhóm (là F có số hiệu nguyên tử là 9) nhưng mạnh hơn nguyên tố đứng dưới nó trong cùng nhóm (là Br có số hiệu nguyên tử là 35).
2. Biết cấu tạo nguyên tử của nguyên tố có thể suy đoán vị trí và tính chất nguyên tố đó.
Ví dụ:
Biết: Nguyên tố X có điện tích hạt nhân là 11+, nguyên tử X có 3 lớp electron, lớp ngoài cùng có 1 electron.
Xác định được:
+ Nguyên tử X có điện tích hạt nhân là 11+ suy ra X ở ô 11
+ Nguyên tử X có 3 lớp electron nên X ở chu kỳ 3
+ Nguyên tử X có 1e ở lớp ngoài cùng nên X ở nhóm IA.
- Nguyên tố X là kim loại vì ở đầu chu kì
Sơ đồ tư duy: Sơ lược về bảng tuần hoàn các nguyên tố hoá học

- Bài 1 trang 101 SGK Hoá học 9
- Bài 2 trang 101 SGK Hoá học 9
- Bài 3 trang 101 SGK Hoá học 9
- Bài 4 trang 101 SGK Hoá học 9
- Bài 5 trang 101 SGK Hoá học 9
- Bài 6 trang 101 SGK Hoá học 9
- Bài 7 trang 101 SGK Hoá học 9
SGK Hóa lớp 9
Giải bài tập hóa học lớp 9 đầy đủ công thức, lý thuyết, phương trình hóa học, chuyên đề hóa học SGK 9 giúp để học tốt hóa học 9
CHƯƠNG 1: CÁC LOẠI HỢP CHẤT VÔ CƠ
- Bài 1. Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
- Bài 2. Một số oxit quan trọng
- Bài 3. Tính chất hóa học của axit
- Bài 4. Một số axit quan trọng
- Bài 5. Luyện tập: Tính chất hóa học của oxit và axit
- Bài 6. Thực hành: Tính chất hóa học của oxit và axit
- Bài 7. Tính chất hóa học của bazơ
- Bài 8. Một số bazơ quan trọng
- Bài 9. Tính chất hóa học của muối
- Bài 10. Một số muối quan trọng
- Bài 11. Phân bón hóa học
- Bài 12. Mối quan hệ giữa các loại chất vô cơ
- Bài 13. Luyện tập chương 1: Các hợp chất vô cơ
- Bài 14. Thực hành: Tính chất hóa học của bazơ và muối
- Đề kiểm tra 15 phút - Chương 1 - Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) - Chương 1 - Hóa học 9
Đề thi giữa học kì - Hóa học 9
CHƯƠNG 2: KIM LOẠI
- Bài 15. Tính chất vật lí của kim loại
- Bài 16. Tính chất hoá học của kim loại
- Bài 17. Dãy hoạt động hoá học của kim loại
- Bài 18. Nhôm
- Bài 19. Sắt
- Bài 20. Hợp kim sắt: Gang, thép
- Bài 21. Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- Bài 22. Luyện tập chương 2: Kim loại
- Bài 23. Thực hành: Tính chất hóa học của nhôm và sắt
- Bài 24. Ôn tập học kì 1
- Đề kiểm tra 15 phút - Chương 2 - Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) - Chương 2 - Hóa học 9
Đề thi học kì 1 mới nhất có lời giải
CHƯƠNG 3: SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
- Bài 25. Tính chất của phi kim
- Bài 26. Clo
- Bài 27. Cacbon
- Bài 28. Các oxit của cacbon
- Bài 29. Axit cacbonic và muối cacbonat
- Bài 30. Silic. Công nghiệp silicat.
- Bài 31. Sơ lược về bảng tuần hoàn các nguyên tố hoá học
- Bài 32. Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hoá học
- Bài 33. Thực hành: Tính chất hóa học của phi kim và hợp chất của chúng
- Đề kiểm tra 15 phút - Chương 3 – Hóa học 9
CHƯƠNG 4: HIĐROCACBON. NHIÊN LIỆU
- Bài 34. Khái niệm về hợp chất hữu cơ và hoá học hữu cơ
- Bài 35. Cấu tạo phân tử hợp chất hữu cơ
- Bài 36. Metan
- Bài 37. Etilen
- Bài 38. Axetilen
- Bài 39. Benzen
- Bài 40. Dầu mỏ và khí thiên nhiên
- Bài 41. Nhiên liệu
- Bài 42. Luyện tập chương 4: Hiđrocacbon. Nhiên liệu
- Bài 43. Thực hành: Tính chất của Hiđrocacbon
- Đề kiểm tra 15 phút - Chương 4 - Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) - Chương 4 - Hóa học 9
CHƯƠNG 5: DẪN XUẤT CỦA HIĐROCACBON. POLIME
- Bài 44. Rượu etylic
- Bài 45. Axit axetic
- Bài 46. Mối liên hệ giữa etilen, rượu etylic và axit axetic
- Bài 47. Chất béo
- Bài 48. Luyện tập rượu etylic, axit axetic và chất béo
- Bài 49. Thực hành: Tính chất của rượu và axit
- Bài 50. Glucozơ
- Bài 51. Saccarozơ
- Bài 52. Tinh bột và xenlulozơ
- Bài 53. Protein
- Bài 54. Polime
- Bài 55. Thực hành: Tính chất của gluxit
- Bài 56. Ôn tập cuối năm - Hóa học 9
- Đề kiểm tra 15 phút - Chương 5 - Hóa học 9
- Đề kiểm tra 45 phút (1 tiết) - Chương 5 - Hóa học 9
Xem Thêm
Lớp 9 | Các môn học Lớp 9 | Giải bài tập, đề kiểm tra, đề thi Lớp 9 chọn lọc
Danh sách các môn học Lớp 9 được biên soạn theo sách giáo khoa mới của bộ giáo dục đào tạo. Kèm theo lời giải sách bài tập, sách giáo khoa, đề kiểm tra 15 phút, 45 phút (1 tiết), đề thi học kì 1 và học kì 2 năm học 2025 ngắn gọn, chi tiết dễ hiểu.
Toán Học
Vật Lý
Hóa Học
Ngữ Văn
- SBT Ngữ văn lớp 9
- Đề thi vào 10 môn Văn
- Tác giả - Tác phẩm văn 9
- Văn mẫu lớp 9
- Vở bài tập Ngữ văn lớp 9
- Soạn văn 9 chi tiết
- Soạn văn 9 ngắn gọn
- Soạn văn 9 siêu ngắn
Sinh Học
GDCD
Tin Học
Tiếng Anh
- SBT Tiếng Anh lớp 9
- Đề thi vào 10 môn Anh
- SGK Tiếng Anh lớp 9
- SBT Tiếng Anh lớp 9 mới
- Vở bài tập Tiếng Anh 9
- SGK Tiếng Anh lớp 9 Mới
Công Nghệ
Lịch Sử & Địa Lý
- Tập bản đồ Địa lí lớp 9
- SBT Địa lí lớp 9
- VBT Địa lí lớp 9
- SGK Địa lí lớp 9
- Tập bản đồ Lịch sử lớp 9
- SBT Lịch sử lớp 9
- VBT Lịch sử lớp 9
- SGK Lịch sử lớp 9